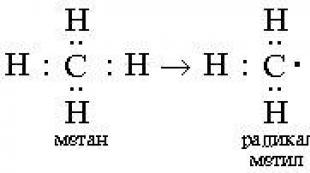Keemia põhimõisted ja seadused. Hemoglobiini molaarmass Hemoglobiini molekulmass
15. Pindaktiivse aine lahusest kontsentratsiooniga 0,2 mol/l adsorbeerub antud temperatuuril 2 96 10 3 mol/g ainet mõne adsorbendi toimel. Määrata adsorbendi adsorptsioonivõime (mol/g), kui konstant a 0,07 mol/l.
[adsorbeerimisvõime 4 00 10 3 mol/g]
16. Arvutage Freundlichi võrrandi abil äädikhappe tasakaalukontsentratsioon lahuses, kui 1 g kivisütt
17. Määrata adsorptsiooni tüüp atsetooni lahustamisel vees, kui atsetooni kontsentratsioon vees on 29 g/l, pind
lahuse pinge - 59 4 |
3 N/m, pindpinevus |
||||||
vesi - 73 49 10 |
3 N/m, T |
||||||
[adsorptsioon positiivne, |
6 mol m2] |
||||||
18. Isovõihappe lahuse kontsentratsiooni tõusuga 0,125-lt 0,250 mol/l-le vähenes selle pindpinevus 55,1-lt 47,9 mN/m-le ja isovaleriinhappe lahuse pindpinevus 43,2-lt 35,0 mN/m-le. Võrrelge ainete adsorptsiooni väärtusi antud kontsentratsioonivahemikus temperatuuril 293 K.
19. Tehke kindlaks, kas pindaktiivse aine adsorptsiooni kogus vesilahustest suureneb või väheneb kontsentratsiooni (T 298 K) suurenemisega, kui on teada järgmised katseandmed:
[adsorptsioon suureneb 2 12 10 6-lt 9 09 10 6 molm2-le koos pindaktiivse aine kontsentratsiooni suurenemisega lahuses]
20. Mitu korda muutub võihappe adsorptsioon vesilahusest katseandmetel (T 288 K) kontsentratsiooni suurenedes:
c 102, |
|||||
3, N/m |

21. Segatud võrdsetes kogustes kaltsiumkloriidi ja väävelhappe 1% lahuseid (eeldades, et tihedus on 1 g/ml). Kirjutage saadud kaltsiumsulfaatsooli mitsellide valemid.
[graanul on negatiivselt laetud]
22. Kui suur hulk hõbenitraadi lahust kontsentratsiooniga 0,001 mol/l tuleks lisada 10 ml naatriumkloriidi lahusele cNaCl 0,002 mol/l, et saada positiivselt laetud graanulid? Kirjutage sooli mitselli ehituse skeem.
[graanul on positiivselt laetud, AgNO 3 lahuse maht peab olema üle 0,02 l]
23. Millise minimaalse koguse ammooniumsulfiidi kontsentratsiooniga 0,001 mol/L tuleks lisada 15 ml mangaan(II)kloriidi lahusele kontsentratsiooniga 0,003 mol/L, et saada negatiivselt laetud osakestega sooli?
24. Preisi sinise Fe 4 Fe CN 6 3 graanul liigub elektriväljas anoodile. Mis aine toimib stabilisaatorina? Kirjutage mitselli valem.
[stabilisaator - K4 Fe CN 6 ]
25. 100 ml 0,03% NaCl lahusele (1 g/ml) lisati 250 ml 0,001 Mr AgNO 3 lahust. Kirjutage lumicelle sol'i valem. Millised järgmistest elektrolüütidest põhjustavad selle madalaima hüübimislävega sooli koagulatsiooni: KCl, Ba NO 3 2,
K2CrO4, MgS04, AlCl3?
[graanul on negatiivselt laetud, seetõttu on koagulantide ioonid katioonid. AlCl3 madalaim hüübimislävi]
26. Ränihappe sool saadi K2 SiO 3 ja HCl lahuste reageerimisel. Kirjutage soolmitselli valem ja määrake, milline elektrolüütidest oli üleliigne, kui vastasioonid liiguvad elektriväljas katoodile?
[liigne K2 SiO 3 ]

27. Millise mahuga 0,001 M FeCl 3 lahust tuleb lisada 0,03 l 0,002 M AgNO 3 lahusele, et hõbekloriidi sooli osakesed liiguksid elektriväljas anoodi poole? Kirjutage mitselsooli valem.
[FeCl 3 maht peab olema üle 0,02 l]
28. Raud(III)hüdroksiidi hüdrosooli koagulatsiooniläved naatriumsulfaadi ja kaaliumkloriidiga on vastavalt 0,32 ja 20,50 mmol/l. Määrake kolloidsete sooli osakeste laengu märk. Arvutage nende elektrolüütide koagulatsioonivõime ja võrrelge nende suhet arvutatud Schulze-Hardy reegliga.
29. Elektrolüütide koagulatsioonivõime teatud sooli suhtes langeb järjestuses: NH 4 3 PO 4 NH 4 2 SO 4 NH 4 NO3. Mis on kolloidosakeste laengumärk? Tooge näiteid elektrolüütide kohta, mille koagulatsioonivõime on ligikaudu võrdne ülaltooduga.
[soolosakesed on positiivselt laetud, ioonide koagulatsioonivõime peaaegu ei vähene: PO 3 4 SO 2 4 NO 3 ]
30. Sooli koagulatsioonilävi magneesiumsulfaadiga on väiksem kui nitratombaariumil. Kuidas sooliosakesed laetakse? Mida saame öelda sama sooli hekoagulatsiooni kohta kaaliumfosfaadiga?
31. Kuldsulfiidsooli koagulatsioon mahuga 1,5 l toimus 570 ml naatriumkloriidi lahuse lisamisel kontsentratsiooniga 0,2 mol/l. Arvutage naatriumioonsooli koagulatsioonilävi.
32. Soolhüdroksiidi ja raudfosfaadi ioonide koagulatsiooni lävi on 0,37 mmol/l. Millises mahus 5% naatriumfosfaadi lahust (105 g/ml) on vaja 750 ml sooli koaguleerimiseks?
[Na 3 PO 4 lahuse maht on 0,87 ml]
33. Kui lisati 10,6 ml lahust K4 Fe CN 6 kontsentratsiooniga 0,01 mol/l, tekkis 2-liitrise alumiiniumhüdroksiidsooli selge koagulatsioon. Arvutage sooli koagulatsiooni lävi heksatsüanoferraadiioonide poolt; kirjutage alumiiniumhüdroksiidi soolmitsellide valem.
34. Kuldsulfiidsooli kaltsiumiioonidega koagulatsiooni lävi on 0,69 mmol/l. Kui suur hulk lahust kaltsiumkloriidi kontsentratsiooniga 0,5 mol/l on vaja 100 ml sooli koaguleerimiseks?
[CaCl2 lahuse maht on 0 15 10 3 l]
35. Määrake sooli kolloidosakeste laengu märk, kui selle elektrolüütidega koagulatsioonil saadakse järgmised koagulatsiooniläved (mmol/l): c tk KNO3 300; c pc MgCl2 320; c tk Na3PO4 0 6.
[positiivne]
36. Millisel elektrolüüdil, Na2SO4 või MgCl2, on suurem koagulatsioonivõime hõbejodiidi sool, mis saadakse, segades võrdsetes kogustes lahust kaaliumjodiidi kontsentratsiooniga 0,01 mol/l ja lahust hõbenitraadi kontsentratsiooniga 0,015 mol/ l?
[Na2SO4 koagulatsioonivõime on suurem]
37. Koaguleerida negatiivselt laetud sooli 10 ml AgI, 1,5 ml lahust KNO3 kontsentratsiooniga 1 mol/l või 0,5 ml lahust Ca NO3 2 kontsentratsiooniga 0,1 mol/l või 0,2 ml lahust. nõutav lahus Al NO3 kontsentratsiooniga 0,01 mol/l . Kas reegel c p 1 z 6 vastab tõele?
[reegel viiakse läbi ligikaudu]
38. Kirjutage KAuO2-ga stabiliseeritud kullasooli mitselli valem. Millise elektrolüüdi – NaCl, BaCl2, FeCl3 – hüübimislävi on madalam?
[FeCl3 puhul on hüübimislävi madalam]
39. Oliiviõli tihedus temperatuuril 22 Æ C on 960 kg m3 ja vee tihedus sellel temperatuuril 996 kg m3. Oliiviõli voolab läbi viskosimeetri 21 minuti 15,6 sekundiga ja sama kogus vett
vesi 22 H2 O 9 58 10 4 N s m2. |
||
[oliiviõli viskoossus 841 3 |
10 4 N s m2 ] |
|
40. Petrooleumi viskoossus 20 °C juures |
Æ C võrdub 18 |
10 3 Pa s ja vis- |
vee luu samadel tingimustel - 1 005 10 |
3 Pa s (N s m2). |
|
Määrake petrooleumi tihedus, kui on teada, et petrooleumi vooluaeg viskosimeetrist on 53 s ja sama veekogus 24 s. Vee tihedus on 998 kg m3.
[petrooleumi tihedus on 809 4 kg m3]
41. Millisele elektroodile liiguvad valguosakesed pI 4 0) elektroforeesi ajal atsetaatpuhvris, mis on valmistatud 100 ml lahusest naatriumatsetaadi kontsentratsiooniga 0,1 mol/l ja 25 ml lahusest, mille äädikhappe kontsentratsioon on 0,2 mol. /l?
[selles puhverlahuses on valk negatiivselt laetud ja liigub elektroforeesi käigus anoodile]
42. Lahus sisaldab valkude segu: globuliin (pI 7), albumiin (pI 4 9) ja kollageen (pI 4 0). Millise pH väärtuse juures saab neid valke elektroforeetiliselt eraldada?
[valke saab elektroforeetiliselt eraldada pH 4-9 juures]
43. Millisele elektroodile liiguvad valguosakesed elektroforeesi ajal, kui selle pI on 4 ja pH on 5?
[valguosakesed liiguvad anoodi poole]
44. Hemoglobiin pI 6 68 pandi puhverlahusesse, mille vesinikioonide kontsentratsioon oli 1 5 10 6 mol/l. Määrake hemoglobiini molekulide liikumissuund elektroforeesi ajal. Teadaolevalt on punalibledes pH 7 25. Milline laeng on hemoglobiini molekulidel selle pH väärtuse juures.
[hemoglobiini molekulid liiguvad katoodi poole; pH 7 juures on 25 hemoglobiini molekulil negatiivne laeng]
45. Valgu vesilahuse massikontsentratsiooniga 1 kg m3 osmootne rõhk füsioloogilisel temperatuuril on 292,7 Pa. Määrake valgu molekulmass keskmise molaarmassi järgi (valgu molekul on isodiameetriline).
[suhteline molekulmass on 87 940]
46. Arvutage keskmine osmootne rõhk 25 tsentratsioonil - 4176 kg m3;
polüstüreeni molaarmass, kui Æ C on 120,9 Pa, ja mass 1 Pa m6 kg2.
47. Kas želatiin (pI 4 7) paisub võrdsete komponentide sisaldusega atsetaatpuhvris temperatuuril 0 Æ C? Kuidas tuvastada želatiini turseprotsessi? Selgitage oma vastust.
[isoelektrilise punkti lähedal on turse minimaalne]
48. Kui kumm kaalus 200 g paisus, neeldus 964 ml kloroformi (1 9 g ml). Arvutage kummi paisumisaste ja saadud tarretise protsentuaalne koostis.
[ 915 8%; kumm 9 84%; kloroform 90 16%]
49. Arvutage polümeeri keskmine molaarmass, kui selle iseloomulik viskoossus on 0 126 m3 kg, konstant K 5 10 5, 0 67.
50. Kui suur polümeeri mass tuleb võtta lahuse valmistamiseks, mille molaarkontsentratsioon on 0,0025 mol/kg,
kui lahusti mass on 1,5 kg? Monomeeri molaarmass on 100 g/mol. Polümerisatsiooniaste - 100.
51. Millise pH väärtuse juures tuleks elektroforeesiga eraldada kaks ensüümi, mille isoelektrilised punktid on 5 ja 3? Kuidas laetakse ensüümiosakesi lahustes, mille pH on 4,6?
ja 7,9?
[tuleks eraldada pH 4 juures; laengud pH 4 juures 6 " " ja " ", pH 7 juures 9 " " ja " "]
52. Määrake polümetüülmetakrülaadi molaarmass, kasutades viskosimeetrilise meetodi järgmisi andmeid:
Keskendumine |
||||||
lahus, kg m3 |
||||||
Vähendatud viskoossus |
||||||
IUD lahus |
||||||
benseenis |
Konstandid: K
105 ] |
53. Mõne BMC molaarmass on 600 000. Kui suur on lahuse molaarkontsentratsioon, kui aine massikontsentratsioon on 6 g/l? Kui suur on sellise lahuse osmootne rõhk temperatuuril 27Æ C?
54. 1 liiter lahust sisaldab 5 g amüloosi. Sellise lahuse osmootne rõhk 27 °C juuresÆ C on 0,15 mm Hg. Art. Arvutage amüloosi molaarmass.
55. Membraani ühele küljele asetatakse valgulahus PrtCl kontsentratsiooniga 0,1 mol/L ja teisele poole naatriumkloriidi kontsentratsiooniga 0,2 mol/L. Kui tasakaal on saavutatud, arvutage kloriidioonide kontsentratsioon membraani mõlemal küljel.
56. Želatiini kuldarvu määramiseks lisati 9,9 ml punase kulla soolile 0,1 ml 1% želatiini lahust. Seejärel tehti algse lahusega 10 järjestikust lahjendust 1 2. Igasse katseklaasi lisati 1 ml 10%
naatriumkloriidi lahus. Esimeses viies katseklaasis muutusi ei täheldatud, kuid katseklaasides 6–10 omandas lahus sinise varjundi. Mis on kuldne number?
57. Määratakse želatiini vesilahuse osmootne rõhk 293 K juures massikontsentratsiooniga 2,5 kg m 3 .
Želatiini molaarmass on 104 600 ja koefitsient
0 69 Pa m6 |
kg 2. |
58. Polüakrüülnitriili molekulmass erinevates kontsentratsioonides difenüülformamiidi lahuses on 75 000 ja 39 100 temperatuuril 293 K ning siseviskoossus on vastavalt 0,299 ja 0,110. Määrake Mark-Houwinki võrrandis koefitsiendid ja K.
59. Mädase meningiidi diagnoosimisel määratakse tserebrospinaalvedeliku valkude kaitsev arv. Arvutage see arv, kui on teada, et 20 ml AgBr sooli hüübimise vältimiseks 2 ml NaNO massiosa lahuse toimel 3 10% oli vaja lisada sellele soolile 3 ml tserebrospinaalvedelikku, mis sisaldas 2 g valke 1 liitris.
60. Isoeklektilises olekus hemoglobiini 26 g/l sisaldava lahuse osmootne rõhk on võrdne 0,0117 g/l naatriumkloriidi sisaldava lahuse osmootse rõhuga. Võtke lahuste tihedus 1 g/ml, temperatuur 25Æ C, kõrvalekalde Van't Hoffi seadusest võib tähelepanuta jätta. Arvutage hemoglobiini molekulmass (molaarne).
RAKENDUS
1. FÜÜSIKALISED PÕHIKONSTAndid
Avogadro konstant, N A 6 02 1023 mol 1. Universaalne gaasikonstant, R 8 31 J mol
Boltzmanni konstant, k R N A 1 38 10 23 J K. Gaasi normaalne molaarmaht, V 0 22 4 l mol. Plancki konstant, h 6 63 10 34 J s.
2. TEGURID JA ETTEPANEKUD KOMMENDKORRALISTE NING RAAMÜHIKITE MOODUSTAMISEKS NING NENDE TÄHISTAMISEKS
Faktor, |
Faktor, |
||||||
mille peal |
mille peal |
||||||
korrutab |
korrutab |
||||||
peamine |
peamine |
||||||
1012 |
|||||||
| meeter | |||||||
kilogrammi |
|||||||
Elektrivoolu tugevus |
|||||||
Termodünaamiline temperatuur |
|||||||
Aine kogus |
|||||||
Tuletatud kogused |
ruum ja aeg |
||||||
ruutmeeter |
|||||||
kuupmeeter |
|||||||
Kiirus |
meeter sekundis |
||||||
Mehaanilised derivaadid |
ja termilised kogused |
||||||
Tihedus |
kilogrammi kohta |
kg m3 |
|||||
kuupmeeter |
|||||||
Jõud, kaal |
|||||||
Surve |
|||||||
Energia, töö, soojushulk, |
|||||||
termodünaamiline potentsiaal |
|||||||
Entroopia |
džauli kelvini kohta |
||||||
Elektrilised derivaadid |
ja magnetilisi koguseid |
||||||
Elektri kogus |
|||||||
termodünaamiline potentsiaal |
|||||||
Elektripinge |
|||||||
elektriline potentsiaal, |
|||||||
elektromotoorjõud |
|||||||
Elektritakistus |
|||||||
Valgud on elusorganismide kõige olulisem ainete klass. Paljud valgud toimivad katalüsaatoritena. Hemoglobiin kannab ka hapnikku kopsudest kudedesse.
25-1. Hemoglobiini molaarmass on g/mol. Punaste vereliblede keskmine hemoglobiinisisaldus on 15 g / 100 ml. Määrake hemoglobiini (M) molaarne kontsentratsioon veres.
25-3. Henry seadus on öeldud järgmiselt:
lahustuvus = kГ´ osarõhk ( kГ – Henry konstant)
Henry hapnikukonstant on 1,3 x 10 –3 mol/l/atm. Hinnake kahe hapnikumolekuli keskmist kaugust vees õhuga tasakaalus.
25-4. Hemoglobiini molekul võib siduda kuni nelja hapnikumolekuli. Hinnake keskmist kaugust kahe hapnikumolekuli vahel hapnikuga rikastatud veres. Võrrelge tulemust küsimuste 25-2 ja 25-3 vastustega. Tehke järeldus hemoglobiini efektiivsuse kohta hapniku kontsentreerimisel ja selle toimetamisel kudedesse, kus hapniku osarõhk on madal.
25-6. Mitu erinevat aminohapet sisaldab hemoglobiini molekul?
25-7. Trüpsiin hüdrolüüsib peptiidsidemeid, mis on moodustatud lüsiini ja arginiini karboksüülrühmadest. Näiteks allpool olev peptiid
pärast trüpsiini toimet laguneb see järgmisteks peptiidideks:
Hemoglobiini redutseeriti disulfiidsidemed ja alküüliti ning seejärel hüdrolüüsiti täielikult trüpsiini toimel. Mitmest aminohappejäägist (keskmiselt) hüdrolüüsiproduktid koosnevad?
Hemoglobiini molaarmass
Hemoglob i n (Hb) (alates hemo. ja lat. globus - pall), punast rauda sisaldav pigment inimeste, selgroogsete ja mõnede selgrootute veres; organismis täidab hapniku (O 2) transportimise funktsiooni hingamisteedest kudedesse; mängib olulist rolli ka süsinikdioksiidi ülekandmisel kudedest hingamisteedesse. Enamikul selgrootutel lahustub glütseriin veres vabalt; selgroogsetel ja mõnedel selgrootutel leidub seda punastes verelibledes – erütrotsüütides, moodustades kuni 94% nende kuivjäägist. Erütrotsüütides sisalduva gaasi molaarmass on umbes, plasmas lahustunud - kuni. Keemilise olemuse järgi on G. kompleksvalk - kromoproteiin , mis koosneb proteiinist globiinist ja raudporfüriinist – heem. Kõrgematel loomadel ja inimestel koosneb veri 4 monomeeri subühikust, mille molaarmass on umbes 17 000; kaks monomeeri sisaldavad kumbki 141 aminohappejääki ( a-ahel), ülejäänud kaks - igaüks 146 jääki ( b-ketid).
Nende polüpeptiidide ruumilised struktuurid on suures osas sarnased. Need moodustavad iseloomulikud "hüdrofoobsed taskud", milles asuvad heemi molekulid (üks iga subühiku kohta). Heemis sisalduva raua aatomi 6 koordinatsioonisidemest 4 on suunatud pürroolitsüklite lämmastikule; 5. on seotud polüpeptiidide hulka kuuluva histidiini imidasoolitsükli lämmastikuga, mis asub 87. kohal. a-ketis ja 92. kohal b-ketid; 6. side on suunatud veemolekulile või muule rühmale (ligandidele), sealhulgas hapnikule. Subühikud on omavahel lõdvalt ühendatud vesiniku, soola ja muude mittekovalentsete sidemetega ning dissotsieeruvad kergesti amiidide ja soolade suurenenud kontsentratsiooni mõjul, moodustades peamiselt sümmeetrilisi dimeerisid ( a b) ja osaliselt a- Ja b-monomeerid. Gaasi molekuli ruumilist struktuuri uuriti röntgendifraktsioonanalüüsiga (M. Peruts, 1959).
Aminohapete järjestus a- Ja b G. ahelad paljudel kõrgematel loomadel ja inimestel on täielikult välja selgitatud. Tetrameeriks kokkupandud heemimolekulis asuvad kõik 4 heemi jääki pinnal ja reaktsioonid O 2 -ga on kergesti ligipääsetavad. O 2 lisamise tagab Fe 2+ aatomi sisaldus heemis. See reaktsioon on pöörduv ja sõltub O2 osarõhust (pingest). Kopsu kapillaarides, kus O 2 pinge on umbes 100 mmHg. Art., G. ühineb O 2-ga (hapnikuprotsess), muutudes hapnikurikkaks G. - hapnikuga rikastatud hemoglobiiniks. Kudede kapillaarides, kus O2 pinge on oluliselt madalam (u. 40 mmHg. Art.), oksühemoglobiin dissotsieerub G.-ks ja O2-ks; viimane siseneb elundite ja kudede rakkudesse, kus O 2 osarõhk on veelgi madalam (5-20 mmHg. cm.); sügaval rakkudes langeb see peaaegu nullini. O 2 lisamisega hemoglobiinile ja oksühemoglobiini dissotsieerumisega hemoglobiiniks ja O 2 -ks kaasnevad hemoglobiini molekuli konformatsioonilised (ruumilised) muutused, samuti selle pöörduv lagunemine dimeerideks ja monomeerideks, millele järgneb agregatsioon tetrameerideks.
Gaasi omadused O 2-ga reageerimisel ja muud omadused muutuvad: hapnikuga rikastatud gaas on gaasist 70 korda tugevam hape, millel on suur roll kudedes seondumisel ja CO 2 vabastamisel kopsudesse. Iseloomulikud on neeldumisribad spektri nähtavas osas: G. on üks maksimum (554 juures mmk), hapnikuga rikastatud gaasil on kaks maksimumi 578 ja 540 juures mmk. G. on võimeline siduma vahetult CO 2 (CO 2 reaktsiooni tulemusena globiini NH 2 -rühmadega); sel juhul moodustub karbhemoglobiin - ebastabiilne ühend, mis laguneb kergesti kopsukapillaarides hemoglobiiniks ja CO 2 -ks.
G. kogus inimese veres on keskmiselt 13-16 G%(ehk Sali järgi 78%-96%); naistel G. on veidi väiksem kui meestel. G. omadused muutuvad ontogeneesi käigus. Seetõttu eristavad nad embrüonaalset G., loote G. (loote) - HbF ja täiskasvanud G. - HbA. Looterakkude hapnikuafiinsus on kõrgem kui täiskasvanutel, millel on oluline füsioloogiline tähendus ja mis tagab loote organismi suurema vastupanuvõime O 2 vaegusele. G. koguse määramine veres on oluline vere hingamisfunktsiooni iseloomustamiseks normaalsetes tingimustes ja väga erinevate haiguste, eriti verehaiguste korral. G. kogus määratakse spetsiaalsete seadmete - hemomeetrite abil.
Mõnede haiguste, aga ka kaasasündinud vereanomaaliate korral (vt. Hemoglobinopaatiad ) erütrotsüütidesse ilmuvad ebanormaalsed (patoloogilised) vererakud, mis erinevad normaalsetest aminohappejäägi asendamise poolest ( - või b-ketid. Ebanormaalse G. sordi on tuvastatud üle 50. Seega on sirprakulise aneemia korral leitud G. b- ahelad, mille N-otsast 6. kohal asuv glutamiinhape on asendatud valiiniga. Selle põhjuseks on hemoglobiini F või H sisaldusega seotud punaste vereliblede kõrvalekalded talasseemia , methemoglobineemia . Mõne ebanormaalse seedetrakti hingamisfunktsioon on tõsiselt häiritud, mis põhjustab mitmesuguseid patoloogilisi seisundeid ( aneemia ja jne). G. omadused võivad muutuda, kui keha mürgitatakse näiteks süsinikmonooksiidiga, mis põhjustab moodustumist. karboksühemoglobiin või mürgid, mis muudavad Fe 2+ heemi methemoglobiini moodustumisega Fe 3+-ks. Need G. derivaadid ei ole võimelised hapnikku kandma. G. erinevatel loomadel on liigispetsiifilisus, mis tuleneb molekuli valguosa ainulaadsest struktuurist. G., mis vabaneb punaste vereliblede hävitamise käigus, on moodustumise allikas sapi pigmendid.
Lihaskude sisaldab lihast G. - müoglobiin , molaarmassi, koostise ja omaduste poolest lähedased G. subühikutele (monomeeridele). Mõnes taimes on leitud G. analooge (näiteks leghemoglobiin leidub kaunviljade sõlmedes).
Lit.: Korzhuev P. A., Hemoglobiin, M., 1964; Gaurowitz F., Valkude keemia ja funktsioonid, trans. inglise keelest, 2. väljaanne, M., 1965, lk. 303-23; Ingram V., Makromolekulide biosüntees, trans. inglise keelest, M., 1966, lk. 188-97; Rapoport S. M., Meditsiiniline biokeemia, tlk. saksa keelest, M., 1966; Perutz M., Hemoglobiini molekul, kogumikus: Molecules and Cells, M., 1966; Zuckerkandl E.; Hemoglobiini evolutsioon, ibid.; Fanelli A. R., Antonini E., Caputo A., Hemoglobiin ja müoglobiin, "Advances in Protein Chemistry", 1964, v. 19, lk. 73-222; Antonini E., Brunori M., Hemoglobiin, "Annual Review of Biochemistry", 1970, v. 39, lk. 977-1042.
G. V. Andreenko, S. E. Severin.
Arvutage ühe hemoglobiini molekuli mass: grammides ja aatommassi ühikutes.
Arvutage ühe hemoglobiini molekuli mass (molekulvalem C 2954 H 4516 N 780 O 806 S 12 Fe 4):
a) grammides; b) aatommassi ühikutes.
Paneme kirja probleemi lühikirjelduse ja selle lahendamiseks vajalikud lisaandmed.
a) Hemoglobiini molekuli massi arvutamiseks peate teadma selle molaarmassi:
M (hemoglobiin) = 2954,12 + 4516,1 + 780,14 + + 806,16 + 12,32 + 4,56 =( g/mol)
Edasist arutlust saab läbi viia kahel viisil.
1. meetod: aine koguse järgi.
Aine kogus on mugav universaalne suurus, mis võimaldab meil seostada aatomite või molekulide arvu, aine massi ja mahtu.
kus m on mass, M on molaarmass, N on aatomite või molekulide arv, N A = 6,02 10 23 mol –1– Avogadro konstant.
Neid valemeid kombineerides saame massi väljendada molekulide arvu kaudu:
Asendades saadud valemiga N = 1, M = g/mol, N A = 6,02·10 23 mol –1, leiame
2. meetod: proportsioonide kasutamine.
6,02 10 23 hemoglobiini molekuli mass on G;
ja 1 hemoglobiini molekuli mass on m G.
b) Molekuli absoluutmass võrdub suhtelise molekulmassiga, mis on korrutatud 1 a-ga. sööma.
Suhteline molekulmass on arvuliselt võrdne molaarmassiga.
Vastus:Ühe hemoglobiini molekuli mass on:
a) 1.07·10 –19 G; b)a. sööma.
Projekt õpilastelt õpilastele! Lihtsustame ülikooli läbimist 50%. Säästame õppimisele kuluvat aega 40%. Suurendage rõõmu 200%!
Keemiku käsiraamat 21
Keemia ja keemiatehnoloogia
Hemoglobiini molekulmass
Raud toimib bioloogilistes oksüdatsiooni-redutseerimisreaktsioonides peamise elektroni kandjana. Raua ioonid, nii Fe+ kui ka Fe+, esinevad inimkehas ja toimides elektronide kandjatena muutuvad pidevalt ühest oksüdatsiooniastmest teise. Seda saab illustreerida tsütokroomide näitega. Raua ioonid teenivad ka molekulaarse hapniku transportimist ja säilitamist – see funktsioon on vajalik kõigi selgroogsete eluks. Selles süsteemis töötab ainult Re(P). Ainevahetusprotsesside hapnikuvajaduse rahuldamiseks on enamikul loomadel vedelik, mis ringleb kogu kehas ja mis kannab hapnikku, absorbeerides seda välisest allikast, kudede mitokondritesse. Siin on vajalik, et hingamisahel vahendaks oksüdatiivset fosforüülimist ja ATP tootmist. Hapniku lahustuvus vees on aga liiga madal, et toetada elusolendite hingamist. Seetõttu sisaldab veri tavaliselt valke, mis seovad pöörduvalt hapnikku. Need valgumolekulid hõlbustavad hapniku tungimist lihastesse (kudedesse) ja võivad toimida ka hapniku hoidjana.
Teisest küljest arvati, et TMV molekulmass on umbes 40 miljonit ja alguses tundus, et TMV struktuuri mõistmine oleks mõõtmatult keerulisem kui palju väiksemate müoglobiini ja hemoglobiini molekulide struktuur, mida John Kendrew ja Max Perutz võitlesid aastaid, kuid pole kunagi saanud bioloogile huvipakkuvaid tulemusi.
Hemoglobiin
Hemoglobiin (Hb) (alates hemo. ja lat. globus – pall), punast rauda sisaldav inimeste, selgroogsete ja mõnede selgrootute verepigment
Hemoglobiini ja selle ühendite neeldumisspektrid: 1 - hemoglobiin; 2 - oksühemoglobiin; 3 - karboksühemoglobiin; 4 - methemoglobiin: B, C, D, E, F, G - päikesespektri peamised Fraunhoferi jooned, lainepikkused on tähistatud numbritega.
Inimese oksühemoglobiini dissotsiatsioonikõver.
Hemoglobiin
Valgumolekuli kuju järgi eristatakse fibrillaarseid ja globulaarseid valke, erirühma moodustavad kompleksvalgud, mille hulka kuuluvad lisaks aminohapetele süsivesikud, nukleiinhapped jne. globiin ja raudporfüriin – heem. Kõrgematel loomadel ja inimestel koosneb veri 4 monomeeri subühikust, mille molaarmass on umbes 17 000; kaks monomeeri sisaldavad 141 aminohappejääki (a-ahel), ülejäänud kaks - 146 jääki (a-ahel).
Nende polüpeptiidide ruumilised struktuurid on suures osas sarnased. Need moodustavad iseloomulikud "hüdrofoobsed taskud", milles asuvad heemi molekulid (üks iga subühiku kohta). Heemis sisalduva raua aatomi 6 koordinatsioonisidemest 4 on suunatud pürroolitsüklite lämmastikule; 5. on seotud polüpeptiidide hulka kuuluva histidiini imidasoolitsükli lämmastikuga, mis asub α-ahelas 87. kohal ja β-ahelas 92. kohal; 6. side on suunatud veemolekulile või teistele rühmadele (ligandidele), sealhulgas hapnikule. Subühikud on üksteisega lõdvalt seotud vesiniku, soola ja muude mittekovalentsete sidemetega ning dissotsieeruvad kergesti amiidide ja soolade suurenenud kontsentratsiooni mõjul, moodustades peamiselt sümmeetrilisi dimeere (a) ja osaliselt a- ja p-monomeere. Hemoglobiini molekuli ruumilist struktuuri uuris 1959. aastal röntgendifraktsioonanalüüsiga inglise biokeemik Max Ferdinand Perutz.
Aminohapete järjestus hemoglobiini α- ja β-ahelates paljudel kõrgematel loomadel ja inimestel on täielikult välja selgitatud. Tetrameeriks kokkupandud heemimolekulis asuvad kõik 4 heemi jääki pinnal ja reaktsioonid O 2 -ga on kergesti ligipääsetavad. O 2 lisamise tagab Fe 2+ aatomi sisaldus heemis. See reaktsioon on pöörduv ja sõltub O2 osarõhust (pingest). Kapillaarides on kapillaarid väikseimad veresooned, mis tungivad läbi elundite ja kudede. Nad ühendavad arterioole veenidega (kõige väiksemad veenid) ja sulgevad vereringe; nende seinte kaudu toimub ainete vahetus vere ja kudede vahel (verekapillaarid). Lümfikapillaarid moodustavad lümfisooned, soodustavad vedeliku väljavoolu kudedest ning eemaldavad organismist võõrosakesi ja patogeenseid baktereid. kopsud, kus O 2 pinge on umbes 100 mm Hg. Art., G. ühendab O 2-ga (hapnikuprotsess Oxygenation - hapnikuga küllastumine.), muutudes hapnikuga küllastunud G. - hapnikuga hemoglobiiniks. Kudede kapillaarides, kus O 2 pinge on palju madalam (umbes 40 mm Hg), dissotsieerub oksühemoglobiin hemoglobiiniks ja hapnikuks O 2; viimane satub elundite ja kudede rakkudesse, kus O 2 osarõhk on veelgi madalam (5-20 mm Hg); sügaval rakkudes langeb see peaaegu nullini. O 2 lisamisega hemoglobiinile ja oksühemoglobiini dissotsieerumisega hemoglobiiniks ja O 2 -ks kaasnevad hemoglobiini molekuli konformatsioonilised (ruumilised) muutused, samuti selle pöörduv lagunemine dimeerideks ja monomeerideks, millele järgneb agregatsioon tetrameerideks.
Hapnikuga O 2 reageerimisel muutuvad ka teised hemoglobiini omadused: hapnikuga rikastatud hemoglobiin on hemoglobiinist 70 korda tugevam hape, millel on suur roll kudedes seondumisel ja CO 2 vabanemisel kopsudes. Iseloomulikud neeldumisribad asuvad spektri nähtavas osas: geoglobiinil on üks maksimum (554 mmk juures) ja hapnikuga rikastatud gaasil on kaks maksimumi 578 ja 540 mmk juures. G. on võimeline otse lisama süsinikdioksiidi (süsinikdioksiidi) CO 2 (CO 2 reaktsiooni tulemusena globiini NH2-rühmadega); sel juhul moodustub karbhemoglobiin - ebastabiilne ühend, mis laguneb kergesti kopsukapillaarides hemoglobiiniks ja CO 2 -ks.
Riis. 1. Hemoglobiini ja selle ühendite neeldumisspektrid: 1 - hemoglobiin; 2 - oksühemoglobiin; 3 - karboksühemoglobiin; 4 - methemoglobiin: B, C, D, E, F, G - päikesespektri peamised Fraunhoferi jooned, lainepikkused on tähistatud numbritega.
Hemoglobiini hulk inimese veres on keskmiselt % (ehk Sali järgi 78% - 96%); naistel G. on veidi väiksem kui meestel. G. omadused muutuvad ontogeneesi käigus. Seetõttu eristavad nad embrüonaalset G., loote G. (loote) - HbF ja täiskasvanud G. - HbA. Looterakkudes on hapnikuafiinsus suurem kui täiskasvanutel, millel on märkimisväärne füsioloogiline Füsioloogiline, füsioloogiline seisund - s.t. selline, mille puhul ei esine kõrvalekaldeid süsteemide ja elundite normaalsest toimimisest. tähtsust ja tagab loote organismi suurema vastupanuvõime O 2 vaegusele. G. koguse määramine veres on oluline vere hingamisfunktsiooni iseloomustamiseks normaalsetes tingimustes ja väga erinevate haiguste, eriti verehaiguste korral. G. kogus määratakse spetsiaalsete seadmete - hemomeetrite abil.
Mõnede haiguste, aga ka kaasasündinud anomaaliate korral on anomaalia keha struktuurne või funktsionaalne kõrvalekalle, mis on põhjustatud embrüo arengu häiretest. Teravalt väljendunud kõrvalekaldeid nimetatakse väärarenguteks või deformatsioonideks. vere punalibledes, ilmnevad ebanormaalsed (patoloogilised) G., mis erinevad normaalsetest aminohappejäägi asendamise poolest (- või?-ahelates. Ebanormaalset G. on tuvastatud üle 50 sordi. Seega sirprakuline aneemia, G. mille β-ahelatest on leitud N-otsast 6. kohal olev glutamiinhape, mis on asendatud valiiniga.Talasseemia taustal on erütrotsüütide anomaaliad, mis on seotud hemoglobiini F või H sisaldusega. kreeka keelest th?lassa - meri ja h?ima - veri) on Vahemere haigus, pärilik hemolüütiline aneemia, mis tuvastati esmakordselt (1925) Vahemere piirkondade elanikel, põhjustatud hemoglobiini sünteesi häiretest, methemoglobineemia. Hingamisfunktsioon mõnede ebanormaalsete hemoglobiinide sisaldus on järsult kahjustatud, mis põhjustab mitmesuguseid patoloogilisi seisundeid (aneemia jne). Hemoglobiini omadused võivad muutuda, kui keha on mürgitatud, näiteks süsinikmonooksiid, mis põhjustab karboksühemoglobiini moodustumist, või mürgid, mis muudavad Fe 2+ heem Fe 3+-ks koos methemoglobiini moodustumisega. Need G. derivaadid ei ole võimelised hapnikku kandma. G. erinevatel loomadel on liigispetsiifilisus, mis tuleneb molekuli valguosa ainulaadsest struktuurist. G., mis vabaneb punaste vereliblede hävitamisel, on sapipigmentide moodustumise allikas.
Lihaskoes on lihaste hemoglobiin – müoglobiin Müoglobiin on kerakujuline valk, mis talletab lihastes hapnikku. , molaarmassi, koostise ja omaduste poolest lähedased G. subühikutele (monomeeridele). Mõnes taimes on leitud G. analooge (näiteks leghemoglobiini leidub kaunviljade sõlmedes).
Riis. 2. Inimese oksühemoglobiini dissotsiatsioonikõver.
Täpsemalt hemoglobiini kohta saab uurida kirjandusest: Korzhuev P. A., Hemoglobin, M., 1964; Gaurowitz F., Valkude keemia ja funktsioonid, trans. inglise keelest, 2. väljaanne, M., 1965, lk. 303-23; Ingram V., Makromolekulide biosüntees, trans. inglise keelest, M., 1966, lk. 188-97; Rapoport S. M., Meditsiiniline biokeemia, tlk. saksa keelest, M., 1966; Perutz M., Hemoglobiini molekul, kogumikus: Molecules and Cells, M., 1966; Zuckerkandl E.; Evolutsioon Evolutsioon (bioloogias) on eluslooduse pöördumatu ajalooline areng. Määravad organismide varieeruvus, pärilikkus ja looduslik valik. Sellega kaasneb nende kohanemine eksisteerimistingimustega, liikide teke ja väljasuremine, biogeotsenooside ja biosfääri kui terviku muundumine. hemoglobiin, ibid.; Fanelli A. R., Antonini E., Caputo A., Hemoglobiin ja müoglobiin, "Advances in Protein Chemistry", 1964, v. 19, lk. 73 - 222; Antonini E., Brunori M., Hemoglobiin, "Annual Review of Biochemistry", 1970, v. 39, lk. 977 - 1042. (G. V. Andreenko, S. E. Severin)
Otsige midagi muud huvitavat:
- Enne teabe kasutamist pidage nõu oma arstiga! Mark Twain: Olge terviseteemalisi raamatuid lugedes ettevaatlik. Sa võid kirjavea tõttu surra.
Kommentaarid artikli kohta
Vere koostise parandamiseks ja hemoglobiini suurendamiseks valmistage see puder.
Sega 1 klaas tatart ja 1 klaas keefirit ning jäta 12 tunniks seisma. Lisa maitse järgi mett.
Söö seda putru hommikusöögiks või õhtul. Võrreldes teiste teraviljadega sisaldab tatar vähe süsivesikuid, mistõttu on see ülekaalulistele ja diabeetikutele väga kasulik.
Hemoglobiini tõstmiseks: riivi 300 g toorest porgandit ja peeti jämedale riivile, lisa 300 g mett. Sega läbi ja jahuta.
Võtke 1 spl. 1 kord päevas, hommikul tühja kõhuga 30 minutit. enne sööki.
Nädala pärast tõuseb hemoglobiin normaalseks (võib-olla kahekordseks!).
Kuidas tõsta hemoglobiini ilma lihata
Hemoglobiini taset saab tõsta ka järgmiste toodetega:
kliid, nisupuder, aprikoosid, kuivatatud aprikoosid, tume šokolaad, rohelised õunad, teraleib, punased viinamarjad, peet, kaunviljad, mandlid, granaatõunad, ploomimahl, ploomid, rosinad, herned, tomatimahl, rooskapsas, brokkoli, maapähklivõi, kaerahelbed, ananassid (värsked ja konserveeritud).
Kõik need toidud on rikkad raua poolest, mis suurendab hemoglobiinisisaldust. Ja paljud loetletud tooted on rauasisalduselt võrreldavad lihaga.
Spetsiaalsed retseptid hemoglobiini suurendamiseks
Valige alljärgnevate retseptide hulgast endale sobivaim ja proovige seda jooksvalt kasutada organismi “vitamiinilisandina”.
1) Jahvata klaas kreeka pähkleid ja klaas toortatart, lisa klaas mett, sega kõik läbi, söö iga päev supilusikatäis.
2) Kreeka pähklid, kuivatatud aprikoosid, mesi, rosinad - kõik vahekorras 1:1 - jahvatage ja segage hoolikalt, sööge 1-3 supilusikatäit päevas (üks parimaid retsepte mitte ainult hemoglobiini tõstmiseks, vaid ka keha varustamiseks vajalikud vitamiinid).
3) Jahvata 1 klaas ploome, kuivatatud aprikoose, kreeka pähkleid, rosinaid, lisa mett, lisa 1-2 koorega sidrunit (sidruni asemel võib lisada aaloemahla), süüa 1-3 spl päevas.
4) 100 ml värskelt pressitud peedimahla, 100 ml porgandimahla, sega ja joo (tõstab hemoglobiini sõna otseses mõttes 2 päevaga).
5) 1/2 tassi õunamahla, 1/4 tassi peedimahla ja 1/4 tassi porgandimahla, segada ja juua 1-2 korda päevas.
6) 1/2 tassi värskelt pressitud õunamahla, 1/2 tassi omatehtud jõhvikamahla, 1 spl värskelt pressitud peedimahla, segage ja jooge.
7) Toortatar 1/2 tassi, loputa, vala 1 kl keefirit ja jäta ööseks, hommikuks on puder valmis, võib süüa.
8) 1/2 tassi kvaliteetset kuiva punast veini, aurutatud veevannis 5-7 minutit; 1/4 kl keedetud nõgest, 1 sl sulavõid, juua soojalt.
Hemoglobiini molaarmass
HEMOGLOBIN, Hb ( hemoglobiin; kreeka keel haima veri + lat. globus ball), on hemoproteiin, heemi sisaldavate kromoproteiinide hulka kuuluv kompleksvalk; teostab hapniku ülekandmist kopsudest kudedesse ja osaleb süsinikdioksiidi ülekandmisel kudedest hingamisorganitesse. G. leidub kõigi selgroogsete ja mõnede selgrootute (ussid, molluskid, lülijalgsed, okasnahksed) erütrotsüütides, aga ka osade kaunviljade juuresõlmedes. Mol. inimese punaste vereliblede kaal (mass) on võrdne; Üks erütrotsüüt sisaldab u. 400 miljonit G. G. molekuli lahustub hästi vees, ei lahustu alkoholis, kloroformis ja eetris ning kristalliseerub hästi (G. kristallide kuju on loomati erinev).
G. koostis sisaldab lihtsat valku - globiini ja rauda sisaldavat proteeside (mittevalgu) rühma - heemi (vastavalt 96 ja 4% molekuli massist). Kui pH on alla 2,0, jaguneb heemimolekul heemiks ja globiiniks.
Heem (C 34 H 32 O 4 N 4) on raua protoporfüriin – protoporfüriini IX kompleksühend kahevalentse rauaga. Raud asub protoporfüriini südamiku keskel ja on ühendatud pürrooli tuumade nelja lämmastikuaatomiga (joonis 1): kahe koordinatsioonisidemega ja kahe vesinikasendussidemega.
Kuna raua koordinatsiooniarv on 6, jääb kasutamata kaks valentsi, millest üks realiseerub heemi seondumisel globiiniga ja teisega liituvad hapnik või muud ligandid - CO, F +, asiidid, vesi (joon. 2), jne.
Protoporfiin IX kompleksi Fe 3+ -ga nimetatakse hematiiniks. Hematiini vesinikkloriidhappe sool (kloorhemiin, hemiin) eritub kergesti. kristalne vorm (nn Teichmanni kristallid). Heemil on võime moodustada kompleksühendeid lämmastikuühenditega (ammoniaak, püridiin, hüdrasiin, amiinid, aminohapped, valgud jne), muutudes seeläbi hemokromogeenideks (vt.). Kuna heem on kõigil loomaliikidel ühesugune, siis on hemoglobiinide omaduste erinevused tingitud hemoglobiini molekuli valguosa – globiini – struktuurilistest iseärasustest.
Globin
Globiin on albumiini tüüpi valk, mille molekulis on neli polüpeptiidahelat: kaks alfa-ahelat (igaüks sisaldab 141 aminohappejääki) ja kaks beeta-ahelat, mis sisaldavad 146 aminohappejääki. Seega on G. molekuli valgukomponent üles ehitatud erinevate aminohapete 574 jäägist. Primaarset struktuuri, st geneetiliselt määratud aminohapete järjestust globiini polüpeptiidahelates inimestel ja paljudel loomadel, on täielikult uuritud. Inimese globiini eripäraks on isoleutsiini ja tsüstiini aminohapete puudumine selle koostises. Alfa- ja beetaahela N-terminaalsed jäägid on valiini jäägid. Alfa-ahelate C-otsa jääke esindavad arginiinijäägid ja beeta-ahelaid histidiinijäägid. Iga ahela eelviimase positsiooni hõivavad türosiinijäägid.
Kristallide röntgenstruktuurianalüüs võimaldas välja selgitada selle molekuli ruumilise struktuuri põhijooned [M. Perutz]. Selgus, et alfa- ja beetaahelad sisaldavad erineva pikkusega spiraalseid segmente, mis on üles ehitatud alfa-heeliksi põhimõttel (sekundaarne struktuur); Alfaahelal on 7 ja beetaahelal 8 spiraalset segmenti, mis on ühendatud mittespiraalsete osadega. N-otsast algavad spiraalsed segmendid on tähistatud ladina tähestiku tähtedega (A, B, C, D, E, F, G, H) ja spiraalsete lõikude või spiraalide pöördenurkadega on vastav tähistus (AB, BC, CD, DE jne). Mittespiraalsed piirkonnad globiiniahela amiini (N) või karboksüül (C) otsas on tähistatud vastavalt NA või HC. Aminohappejäägid on igas segmendis nummerdatud ja lisaks on sulgudes antud selle jäägi nummerdamine ahela N-otsast.
Spiraalsed ja mittespiraalsed lõigud paiknevad ruumis teatud viisil, mis määrab globiiniahelate tertsiaarse struktuuri. Viimane on G. alfa- ja beetaahelates peaaegu identne, hoolimata nende esmase struktuuri olulistest erinevustest. See on tingitud aminohapete polaarsete ja hüdrofoobsete rühmade spetsiifilisest paigutusest, mis põhjustab mittepolaarsete rühmade akumuleerumist gloobuli siseosas koos hüdrofoobse südamiku moodustumisega. Valgu polaarsed rühmad on silmitsi vesikeskkonnaga, olles sellega kontaktis. Iga globiini ahela sees, pinna lähedal, on hüdrofoobne õõnsus ("heemi tasku"), milles heem asub, orienteeritud nii, et selle mittepolaarsed asendajad on suunatud molekuli sisemusse, muutudes hüdrofoobse tuuma osaks. Tulemuseks on u. 60 mittepolaarset kontakti heemi ja globiini vahel ning heemi üks või kaks polaarset (ioonset) kontakti alfa- ja beetaahelatega, mis hõlmavad heemi propioonhappe jääke, mis väljuvad hüdrofoobsest “taskust”. Heemi paiknemine globiini hüdrofoobses õõnsuses annab võimaluse hapniku pööratavaks lisamiseks heemi Fe 2+-le ilma viimase oksüdeerumiseta Fe 3+-ks ja on iseloomulik erinevate loomaliikide hemoglobiinidele. Seda kinnitab G. äärmine tundlikkus mittepolaarsete kontaktide muutuste suhtes heemi lähedal. Seega põhjustab hematopofüriini heemi asendamine hematoporfüriiniga heemi omaduste järsu rikkumise.
Mõned hüdrofoobses õõnsuses heemi ümbritsevad aminohappejäägid kuuluvad muutumatute aminohapete hulka, st aminohapete hulka, mis on erinevatel loomaliikidel samad ja G funktsiooni jaoks hädavajalikud. Invariantsete aminohapete hulgas on kolm suurt tähtsust. : histidiinijäägid, nn. proksimaalsed histidiinid (87. positsioon a- ja 92. positsioon P-ahelates), distaalsed histidiinid (58. positsioon a- ja 63. positsioon (5-ahelas), samuti valiini jääk E-11 (62. positsioon alfas) ahel ja 67. positsioon beetaahelas).
Seos nn proksimaalne histidiin ja heemraud on ainus kemikaal. side nende vahel (teostub heemi Fe 2+ aatomi viies koordinatsiooniside) ja mõjutab otseselt hapniku lisandumist heemile. "Distaalne" histidiin ei ole otseselt seotud heemiga ega osale hapniku sidumises. Selle tähtsus on stabiliseerida Fe 2+ aatomit pöördumatu oksüdatsiooni vastu (ilmselt hapniku ja lämmastiku vahelise vesiniksideme tekkimise tõttu). Valiini jääk (E-11) on omamoodi heemidele hapniku lisamise kiiruse regulaator: beetaahelates paikneb see steeriliselt nii, et see hõivab koha, kus hapnik peaks ühinema, mille tulemusena algab hapnikuga varustamine fla-ahelatega. .
Valguosa ja molekuli proteesrühm avaldavad teineteisele tugevat mõju. Globiin muudab paljusid heemi omadusi, andes sellele võime siduda hapnikku. Heem tagab globiini vastupidavuse ravimite toimele, kuumutamisele, ensüümide lagunemisele ja määrab G kristalliseerumisomaduste omadused.
Polüpeptiidahelad, mille külge on kinnitatud heemmolekulid, moodustavad neli põhiosa - heemmolekuli alaühikud.Nende omavahelise seose (ladumise) olemuse ja paiknemise ruumis määravad heemi kvaternaarse struktuuri tunnused: a- ja P-ahelad asuvad tetraeedri nurkades ümber sümmeetriatelje, pealegi asuvad alfa-ahelad p-ahelate peal ja näivad olevat nende vahele pigistatud ning kõik neli heemi on üksteisest kaugel (joonis 1). . 3). Üldiselt moodustub tetrameerne sferoidne osake mõõtmetega 6,4 x 5,5 x 5,0 nm. Kvaternaarset struktuuri stabiliseerivad soolasidemed α-α ja β-β ahelate vahel ning kahte tüüpi kontaktid α- ja β-ahelate vahel (α1-β1 ja α2-β2). α1-β1 kontaktid on kõige ulatuslikumad, hõlmates 34 aminohappejääki, ja enamik interaktsioone on mittepolaarsed. α1-β2 kontakt koosneb 19 aminohappejäägist, enamik sidemeid on samuti mittepolaarsed, välja arvatud mõned vesiniksidemed. Kõik selles kontaktis asuvad jäägid on kõigil uuritud loomaliikidel ühesugused, samas kui 1/3 α1-β1 kontaktide jääkidest on erinevad.
Inimnääre on heterogeenne, mis on tingitud selle koostise moodustavate polüpeptiidahelate erinevusest. Seega sisaldab täiskasvanud inimese veresuhkur, mis moodustab 95-98% vere glükoosist (HbA), kahte α- ja kahte β-ahelat; G. väike fraktsioon (HbA2), mille maksimaalne sisaldus on 2,0–2,5%, sisaldab kahte α- ja kahte σ-ahelat; Loote hemoglobiin (HbF) ehk loote hemoglobiin, mis moodustab täiskasvanud inimese veres 0,1-2%, koosneb kahest α- ja kahest γ-ahelast.
Loote G. asendatakse esimestel kuudel pärast sündi HbA-ga. Seda iseloomustab märkimisväärne vastupidavus termilisele denaturatsioonile, millel põhinevad selle sisalduse määramise meetodid veres.
Sõltuvalt polüpeptiidahelate koostisest on loetletud G. tüübid tähistatud järgmiselt: HbA - kui Hbα2β2, HbA2 - kui Hbα2σ2 ja HbF - kui Hbα2γ. Kaasasündinud anomaaliate ja vereloomeaparaadi haiguste korral ilmnevad ebanormaalsed vereloome tüübid, näiteks sirprakuline aneemia (vt), talasseemia (vt), mitteensümaatilise päritoluga kaasasündinud methemoglobineemia (vt Methemoglobineemia) jne. Kõige tavalisem asendus. ühest aminohappest ühes polüpeptiidahela paaris.
Sõltuvalt heemi raua aatomi valentsusest ja heemi molekulis oleva ligandi tüübist võib viimane olla mitmel kujul. Redutseeritud vesinikul (desoksü-Hb) on vaba kuuenda valentsiga Fe 2+, millele O 2 lisamisel tekib vesiniku hapnikuga rikastatud vorm (HbO 2). Kui HbO 2 puutub kokku mitmete oksüdeerivate ainetega (kaaliumferritsüaniid, nitritid, kinoonid jne), oksüdeerub Fe 2+ Fe 3+-ks, moodustades methemoglobiini, mis ei ole võimeline O 2 üle kandma. Sõltuvalt söötme pH väärtusest eristatakse methemoglobiini happelisi ja aluselisi vorme, mis sisaldavad kuuenda ligandina H 2 O või OH rühma. Tervete inimeste veres on methemoglobiini kontsentratsioon 0,83 + 0,42%.
Methemoglobiinil on võime kindlalt siduda vesinikfluoriidi, vesiniktsüaniidhapet ja muid aineid. Seda omadust kasutatakse mees. tsüaniidhappega mürgitatud inimeste päästmise praktika. Erinevad G. derivaadid erinevad neeldumisspektrite poolest (tabel).
Lainepikkus (maksimaalsel neeldumisel), nm
Milliekvivalentne valguse neeldumistegur, E
Methemoglobiin (met-Hb; pH 7,0–7,4)
Hemoglobiini funktsionaalsed omadused. Gaasi peamine bioloogiline roll on osalemine keha ja väliskeskkonna vahelises gaasivahetuses. G. tagab hapniku ülekande verega kopsudest kudedesse ja süsihappegaasi transpordi kudedest kopsu (vt Gaasivahetus). Vähem olulised pole ka hemoglobiini puhverdavad omadused, mis moodustavad veres võimsaid hemoglobiini ja oksühemoglobiini puhversüsteeme, aidates seega kaasa happe-aluse tasakaalu säilitamisele organismis (vt Puhversüsteemid, Happe-aluse tasakaal).
HbO 2 hapnikumaht on 1,39 ml O 2 1 g HbO 2 kohta. G. võimet siduda ja vabastada hapnikku peegeldab tema hapniku dissotsiatsioonikõver (ODC), mis iseloomustab G. hapnikuga küllastumise protsenti sõltuvalt O 2 osarõhust (pO 2).
Hapniku tetrameersetel molekulidel on S-kujuline CDK, mis näitab, et hapnik tagab hapniku optimaalse sidumise suhteliselt madala osarõhu korral kopsudes ja hapniku vabanemise suhteliselt kõrge osarõhu korral kudedes (joonis 4). Maksimaalne hapniku kohaletoimetamine kudedesse on kombineeritud kõrge osarõhu säilimisega veres, mis tagab hapniku tungimise sügavale kudedesse. Hapniku osarõhu väärtus mm Hg. Art., kui 50% gaasist on hapnikuga küllastunud, on gaasi hapnikuafiinsuse mõõt ja tähistatakse P50.
Hapniku lisamine G. neljale heemile toimub järjestikku. G. CDK S-kujuline olemus näitab, et esimene hapnikumolekul ühineb G.-ga väga aeglaselt, see tähendab, et selle afiinsus G. suhtes on madal, kuna on vaja katkestada soolakontaktid desoksühemoglobiini molekulis. Esimese hapnikumolekuli lisamine aga suurendab ülejäänud kolme heemi afiinsust selle suhtes ning edasine heemi hapnikuga varustamine toimub palju kiiremini (neljanda heemi hapnikuga varustamine toimub 500 korda kiiremini kui esimesega). Järelikult toimub hapniku sidumiskeskuste vahel koostöö. Süsinikmonooksiidi (CO) reaktsiooni mustrid on samad, mis hapniku puhul, kuid süsinikmonooksiidi afiinsus CO suhtes on peaaegu 300 korda kõrgem kui O2 suhtes, mis muudab süsinikmonooksiidi väga mürgiseks. Seega, kui CO kontsentratsioon õhus on 0,1%, on enam kui pool veregaasist seotud mitte hapniku, vaid süsinikmonooksiidiga. Sel juhul moodustub karboksühemoglobiin, mis ei ole võimeline hapnikku transportima.
Hemoglobiini hapnikuga varustamise protsessi regulaatorid. Hapniku- ja deoksügeenimisprotsesse mõjutavad suuresti vesinikuioonid, orgaanilised fosfaadid, anorgaanilised soolad, temperatuur, süsinikdioksiid ja mõned muud ained, mis reguleerivad vesiniku afiinsust hapniku suhtes vastavalt füsioolile. keha taotlused. Vesiniku hapnikuafiinsuse sõltuvust keskkonna pH väärtusest nimetatakse Bohri efektiks (vt Verigo efekt). Seal on "hapud" (pH<6) и «щелочной» эффект Бора (pH>6). Suurim füsiool. Oluline on "aluseline" Bohri efekt. Selle molekulaarne mehhanism on tingitud paljude positiivselt laetud funktsionaalrühmade olemasolust hemoglobiini molekulis, mille dissotsiatsioonikonstandid on desoksühemoglobiinis palju kõrgemad, kuna hemoglobiini molekulis naabervalguahelate negatiivselt laetud rühmade vahel moodustuvad soolasildad. Hapnikuga varustamisel tekivad hemoglobiini molekulis toimuvate konformatsiooniliste muutuste tõttu soolasillad, hävivad, negatiivselt laetud rühmade pH muutub ja lahusesse eralduvad prootonid. Järelikult põhjustab hapnikuga varustamine prootoni (H +) eraldumise gaasimolekulist ja vastupidi, keskkonna pH väärtuse, st kaudselt H + ioonide kontsentratsiooni muutus mõjutab hapniku lisamist gaasile. Seega muutub H + ligandiks, mis seondub eelistatult desoksühemoglobiiniga ja vähendab seeläbi selle afiinsust hapniku suhtes, st pH muutus happelisele poolele põhjustab CDC nihke paremale. Hapnikuga varustamise protsess on endotermiline ja temperatuuri tõus soodustab hapniku eraldamist G-molekulist, mistõttu elundite suurenenud aktiivsus ja veretemperatuuri tõus põhjustavad CDC nihke paremale ja hapniku kohaletoimetamist. kudedele suureneb.
Erütrotsüütides paiknevad orgaanilised fosfaadid viivad läbi hapnikuga varustamise protsessi ainulaadse reguleerimise. Eelkõige vähendab 2,3-difosfoglütseraat (DPG) oluliselt G. afiinsust hapniku suhtes, soodustades O 2 eemaldamist oksühemoglobiinist. DPG mõju G.-le suureneb koos pH väärtuse langusega (füsioolis, piirkonnas), seetõttu avaldub selle mõju G. CDK-le suuremal määral madalatel pH väärtustel. DPG seondub valdavalt desoksühemoglobiiniga molaarsuhtes 1:1, sisenedes selle molekuli sisemisse õõnsusse ja moodustades 4 soolasilda kahe alfa-NH2 rühmaga beetaahelate valiinijääkidega ja ilmselt kahe imidasoolirühmaga histidiinide H- 21 (143) beetaahelat. DPG mõju väheneb temperatuuri tõustes, st DPG seondumisprotsess G-molekuliga on eksotermiline. See toob kaasa asjaolu, et DPG juuresolekul kaob suures osas hapnikuga varustamise protsessi sõltuvus temperatuurist. Järelikult on hapniku normaalne vabanemine vere kaudu võimalik laias temperatuurivahemikus. Sarnast toimet, kuigi vähemal määral, avaldavad ATP, püridoksaalfosfaat ja teised orgaanilised fosfaadid. Seega mõjutab orgaaniliste fosfaatide kontsentratsioon erütrotsüütides märkimisväärselt G. hingamisfunktsiooni, kohandades seda kiiresti erinevate füsioolide ja patoolidega, mis on seotud hapnikusisalduse halvenemisega * (hapnikusisalduse muutused atmosfääris, verekaotus, reguleerimine). hapniku transport emalt lootele platsenta kaudu jne). Seega suureneb aneemia ja hüpoksiaga DPG sisaldus erütrotsüütides, mis nihutab CDC paremale ja põhjustab suurema hapniku vabanemise kudedesse. Paljud neutraalsed soolad (atsetaadid, fosfaadid, kaalium- ja naatriumkloriidid) vähendavad samuti G. afiinsust hapniku suhtes. See toime sõltub aine olemusest ja sarnaneb orgaaniliste fosfaatide toimega. Kõrge soolakontsentratsiooni juuresolekul saavutab G. afiinsus hapniku suhtes miinimumini – erinevate soolade ja DPG puhul samal määral, st nii soolad kui ka DPG konkureerivad üksteisega samade sidumiskeskuste pärast G-molekulis. Näiteks DPG mõju G. hapnikuafiinsusele kaob 0,5 M naatriumkloriidi juuresolekul.
Veel aastal 1904, Ch. Bohr et al. näitas G. afiinsuse vähenemist hapniku suhtes koos süsinikdioksiidi osarõhu tõusuga veres.
Süsinikdioksiidi sisalduse suurenemine toob kaasa eelkõige keskkonna pH muutuse, kuid P50 väärtus langeb suuremal määral, kui sellise väärtuse languse korral eeldaks.
pH väärtused. See on tingitud süsinikdioksiidi spetsiifilisest seosest alfa-ahelate laenguta alfa-NH2 rühmadega ja võib-olla ka gaasi beeta-ahelatega karbamaatide (karbhemoglobiini) moodustumisega vastavalt järgmisele skeemile:
Deoksühemoglobiin seob rohkem süsinikdioksiidi kui HbO 2. Erütrotsüütides pärsib DPG olemasolu konkureerivalt karbamaatide moodustumist. Karbamaatmehhanismi abil eemaldatakse puhkeolekus tervete inimeste kehast kuni 15% süsihappegaasist. Rohkem kui 70% vere puhvermahust annab selles sisalduv gaas, mis toob kaasa ka gaasi olulise kaudse osalemise süsihappegaasi ülekandes. Kui veri liigub läbi kudede, muutub HbO 2 desoksühemoglobiiniks, sidudes samal ajal H+ ioone ja muutes seeläbi H 2 CO 3 HCO 3 -ks. Seega seotakse G. otsesel ja kaudsel osalusel üle 90% kudedest verre tulevast süsihappegaasist ja kantakse edasi kopsudesse.
On oluline, et kõik need CDC nihke regulaatorid (H +, DPG, CO 2) oleksid omavahel ühendatud, mis on paljude esilekerkivate patoolide seisundite puhul väga oluline. Seega on DPG kontsentratsiooni tõus erütrotsüütides nende ainevahetuse keeruliste muutuste tulemus, mille puhul on peamine tingimus pH väärtuse tõus. Atsidoosi ja alkaloosi korral võrdsustub P50 väärtus ka H + ja DPG vahelise seose tõttu.
Hemoglobiini metabolism
G. biosüntees toimub erütrotsüütide noortes vormides (erütroblastid, normoblastid, retikulotsüüdid), kuhu tungivad G. koostisesse kuuluvad raua aatomid. Glütsiin ja merevaikhape osalevad porfüriinitsükli sünteesis koos δ- moodustamisega. aminolevuliinhape. Viimase kaks molekuli muundatakse pürrooli derivaadiks – porfüriini eelkäijaks. Globiin moodustub aminohapetest, st tavapärasel valgusünteesil. G. lagunemine algab erütrotsüütidest, lõpetades nende elutsükli. Heem oksüdeeritakse läbi alfa-metiini silla, mis lõhub sideme vastavate pürroolitsüklite vahel.
Saadud G. derivaati nimetatakse verdoglobiiniks (roheline pigment). See on väga ebastabiilne ja laguneb kergesti raua iooniks (Fe 3+), denatureeritud globiiniks ja biliverdiiniks.
Haptoglobiini-hemoglobiini kompleksil (Hp-Hb) on suur tähtsus G. katabolismis. Erütrotsüüdist vereringesse väljumisel seondub G. pöördumatult Hp-Hb kompleksis oleva haptoglobiiniga (vt.). Pärast kogu Hp koguse ammendumist plasmas imendub G. neerude proksimaalsetesse tuubulitesse. Suurem osa globiinist laguneb neerudes 1 tunni jooksul.
Heemi katabolismi Hp-Hb kompleksis viivad läbi maksa, luuüdi ja põrna retikuloendoteliaalsed rakud koos sapipigmentide moodustumisega (vt.). Selles protsessis vabanev raud siseneb väga kiiresti metaboolsesse kogumisse ja seda kasutatakse uute rauamolekulide sünteesil.
Hemoglobiini kontsentratsiooni määramise meetodid. Kiiludes määratakse G. tavaliselt kolorimeetrilise meetodiga, kasutades Sali hemomeetrit, mis põhineb G.-st moodustunud hemiini koguse mõõtmisel (vt Hemoglobinomeetria). Sõltuvalt bilirubiini ja methemoglobiini sisaldusest veres, aga ka mõne patooli seisundi korral ulatub meetodi viga +30%. Spektrofotomeetrilised uurimismeetodid on täpsemad (vt Spektrofotomeetria).
Üldhemoglobiini määramiseks veres kasutatakse tsüaanmethemoglobiini meetodit, mis põhineb kõigi hemoglobiini derivaatide (desoksü-Hb, HbO 2, HbCO, met-Hb jne) muundamisel tsüaan-met-Hb-ks ja optilise tiheduse mõõtmisel. lahusest 540 nm juures. Samal eesmärgil kasutatakse püridiin-hemokromogeenset meetodit. HbO 2 kontsentratsioon määratakse tavaliselt valguse neeldumise teel 542 nm juures või gasomeetrilise meetodiga (seotud hapniku koguse järgi).
Hemoglobiin kliinilises praktikas
G. kvantitatiivse sisalduse ja kvalitatiivse koostise määramist kasutatakse kombinatsioonis teiste hematoolidega. indikaatorid (hematokrit, punaste vereliblede arv, nende morfoloogia jne) mitmete patoolide, punaste verehaiguste (aneemia, erütreemia ja sekundaarne erütrotsütoos) diagnoosimiseks, verekaotuse määra, vere paksenemise määramiseks dehüdratsiooni ajal. keha ja põletused jne), et hinnata hemo -ülekannete efektiivsust ravi ajal jne.
Tavaliselt on G. sisaldus veres meestel keskmiselt 14,5 + 0,06 g% (variatsioonid 13,0-16,0 g%) ja naistel 12,9 + 0,07 g% (12,0-14,0 g%), vastavalt L. E. Yarustovskaya jt. (1969); kõikumised sõltuvad keha vanusest ja põhiseaduslikest omadustest, füüsilised. aktiivsus, toitumine, kliima, hapniku osarõhk ümbritsevas õhus. G. kontsentratsioon veres on suhteline väärtus, mis ei sõltu mitte ainult kogu G. absoluutsest kogusest veres, vaid ka plasma mahust. Plasma mahu suurenemine konstantse G. kogusega veres võib anda G. määramisel alahinnatud näitajaid ja imiteerida aneemiat.
G. sisalduse täielikumaks hindamiseks kasutatakse ka kaudseid indikaatoreid: värviindikaatori määramine, keskmine G. sisaldus ühes punaveres, keskmine raku G. kontsentratsioon hematokriti indeksi suhtes jne.
Aneemia raskete vormide korral põhjustab G. kontsentratsiooni langus veres teatud kriitilise väärtuseni - 2–3 g% ja alla selle (hemoglobinopeenia, oligokroemia) - tavaliselt surmani, kuid teatud tüüpi kroonilise aneemia korral , kohanevad üksikud patsiendid kompensatsioonimehhanismide arengu tõttu sellise kontsentratsiooniga.
Patoolis ei muutu seisundid, G. sisaldus ja punaste vereliblede arv alati paralleelselt, mis kajastub aneemia klassifikatsioonis (eristatakse aneemia normaalset, hüpo- ja hüperkroomset vormi); Erütreemiat ja sekundaarset erütrotsütoosi iseloomustab G. suurenenud kontsentratsioon (hüperkroemia) ja punaste vereliblede arvu suurenemine samal ajal.
Peaaegu kogu vere glükoos sisaldub punastes verelibledes; osa sellest on plasmas Hp-Hb kompleksi kujul. Plasma vaba glükoosisisaldus on tavaliselt 0,02-2,5 mg% (vastavalt G.V. Dervizi ja N.K. Byalko andmetele). Vaba hemolüüsi sisaldus plasmas suureneb mõne hemolüütilise aneemia korral, mis esineb peamiselt intravaskulaarse hemolüüsi korral (vt Hemoglobineemia).
Mitmete normaalset tüüpi hemoglobiinide esinemise ja mitme erineva päritoluga ebanormaalsete hemoglobiinide haiguste esinemise tõttu veres (vt Hemoglobinopaatiad) pööratakse suurt tähelepanu hemoglobiini kvalitatiivse koostise määramisele erütrotsüütides (“hemoglobiini valem” ”). Seega on G. tüüpi HbF ja HbA2 suurenenud koguste tuvastamine tavaliselt iseloomulik mõnele beeta-talasseemia vormile.
HbF sisalduse suurenemist täheldati ka teiste hematoolide puhul. haigused (äge leukeemia, aplastiline aneemia, paroksüsmaalne öine hemoglobinuuria jne), samuti nakkuslik hepatiit, asümptomaatiline pärilik loote hemoglobiini püsivus ja rasedus. HbA2 fraktsiooni kontsentratsioon veres suureneb teatud ebastabiilsete gaaside ja mürgistuste korral ning väheneb rauavaegusaneemia korral.
Inimesel ontogeneesi käigus toimub erinevat tüüpi normaalsete hemoglobiinide muutus Lootel (kuni 18 nädalat), primaarne ehk primitiivne tuvastatakse hemoglobiin P (primitiivne); selle sordid on tähistatud samamoodi nagu Hb Gower1 ja Hb Gower2.
Primaarse vereloome ülekaal vastab vitelliini vereloome perioodile ja sellele järgneval maksa vereloome perioodil sünteesitakse valdavalt HbF.
"Täiskasvanute" HbA süntees intensiivistub järsult luuüdi vereloome perioodil; HbF sisaldus vastsündinul on kuni 70-90% kogu G. kogusest (ülejäänud 10-30% langeb HbA fraktsioonile). Esimese eluaasta lõpuks väheneb HbF kontsentratsioon tavaliselt 1-2%-ni ja vastavalt suureneb ka HbA sisaldus.
On teada, et St. 200 G. ebanormaalset (patoloogilist või ebatavalist) varianti, mille välimus on põhjustatud erinevatest pärilikest defektidest globiini polüpeptiidahelate moodustumisel.
L. Paulingi, Itano (N. A. Itano) jt avastus. 1949. aastal pani patool, hemoglobiin S (inglise keeles sirprakuline sirprakuk) aluse molekulaarhaiguste uurimisele. Ebanormaalsete vereliblede esinemine punastes verelibledes põhjustab tavaliselt (kuid mitte alati) päriliku hemolüütilise aneemia sündroomi (vt.
Enamikku kirjeldatud hemoglobiini variantidest tuleks pidada mitte patoloogilisteks, vaid pigem haruldasteks ebatavalisteks G.S mee vormideks. teatud tähtsus on hemoglobiinidel S, C, D, E, Bart, H, M ja suurel rühmal (ca 60) ebastabiilseid hemoglobiine Ebastabiilseid hemoglobiine nimetatakse ebanormaalseteks hemoglobiinideks, milles ühe aminohappe asendamise tulemusena , muutub molekul oksüdeerivate ainete, kuumutamise ja mitmete muude tegurite toimel ebastabiilseks. GM-rühmad tekivad aminohapete asenduste tulemusena polüpeptiidahelates heem-globiini kontaktide piirkonnas, mis ei põhjusta mitte ainult molekuli ebastabiilsust, vaid ka suurenenud kalduvust methemoglobiini moodustumisele. M-hemoglobinopaatia on sageli päriliku methemoglobineemia põhjuseks (vt.).
G. liigitus põhines algul nende kujutamisel ladina tähestiku tähtedega avamise järjekorras; erandiks on tavaline "täiskasvanu" G., mida tähistatakse tähega A, ja loote G. (HbF). Täht S tähistab ebanormaalset sirpraku G. (sünonüüm HbB-le). Seega peeti ladina tähestiku tähti A-st S-ni üldtunnustatud G-nimetusteks. Vastavalt X International Hematolis vastu võetud tähisele. Kongress (Stockholm, 1964) G. nomenklatuuris ei soovitata edaspidi kasutada tähestiku ülejäänud tähti uute variantide tähistamiseks.
Nüüd on tavaks nimetada G. äsja avastatud vorme leiukoha järgi, kasutades linna (piirkonna), haigla või labori nime, kus uus G. esmakordselt avastati, ja märkides (sulgudes) selle biokeemilise valemi, asukoha ja aminohapete asendamise olemus mõjutatud ahelas. Näiteks Hb Koln (alfa 2 beeta 2 98 val->met) tähendab, et hemoglobiinis Koln oli aminohappe valiini ühe beeta-polüpeptiidahela 98. positsioonil asendus metioniiniga.
Kõik G. sordid erinevad üksteisest füüsikaliste ja keemiliste omaduste poolest. ja füüsiline omadused ja mõned ka funktsionaalsete omaduste järgi, millel põhinevad meetodid erinevate G. variantide tuvastamiseks kliinikus. Avastatud on uus klass ebanormaalseid gaase, mille afiinsus hapniku suhtes on muutunud. G. tüpiseerimisel kasutatakse elektroforeesi ja mitmeid teisi laboratoorseid meetodeid (leeliskindluse ja termilise denaturatsiooni testid, spektrofotomeetria jne).
Elektroforeetilise liikuvuse põhjal jaotatakse G. kiiresti liikuvateks, aeglasteks ja normaalseteks (mille liikuvus on sama kui HbA). Aminohappejääkide asendamine ei too aga alati kaasa molekuli laengu muutumist, mistõttu ei saa mõnda varianti elektroforeesi abil tuvastada.
Hemoglobiin kohtumeditsiinis
G. ja selle derivaadid kohtumeditsiinis on määratud tuvastama vere olemasolu füüsilise tõendi või mis tahes vedelikes G. muutusi põhjustavate ainetega mürgituse diagnoosimisel, et eristada loote või vastsündinu verd täiskasvanu verest. . On tõendeid pärilike tunnuste kasutamise kohta vaidlusaluse isaduse, emaduse ja laste asendamise uurimisel, samuti vere individualiseerimisel asitõendite põhjal.
Immuniseerides loomi inimese hemoglobiiniga, saadi hemoglobiini sadestavad seerumid. Nende seerumite abil saab G-l uuritud plekis kindlaks teha inimvere olemasolu.
Vere olemasolu määramiseks plekkides kasutatakse mikrospektraalanalüüsi ja mikrokristallilisi reaktsioone. Esimesel juhul muudetakse hemokromogeen leelise ja redutseerija toimel hemokromogeeniks, millel on iseloomulik neeldumisspekter (vt Hemokromogeen), või hemokromogeenile mõjub kontsentreeritud väävelhape, mis viib hematoporfüriini moodustumiseni. tüüpiline neeldumisspekter spektri nähtavas osas .
Vere olemasolu määramiseks kasutatavatest mikrokristallilistest reaktsioonidest kasutatakse kõige sagedamini hemokromogeeni ja hemiinvesinikkloriidi kristallide tootmisel põhinevaid teste. Hemiinkristallide saamiseks koest, millel on G. uuritud plekk, võtke niit ja asetage see klaasklaasile, lisage mitu naatriumkloriidi kristalli ja mõni tilk kontsentreeritud äädikhapet (Teichmanni reaktiiv). Kuumutamisel (vere juuresolekul) tekivad G.-st hemiinvesinikkloriidi kristallid (Teichmanni kristallid) - pruunid kaldus rööpkülikukujulised, mõnikord kasutatakse reaktsioone joodi-hemiini kristallide saamiseks G.-st - väikesed mustad kristallid, mille kuju on rombilised prismad.
G. derivaadid tuvastatakse spektroskoopiliselt veres teatud mürgistuste korral. Näiteks vingugaasimürgistuse korral leitakse ohvrite verest karboksühemoglobiini, methemoglobiini moodustavate ainetega mürgituse korral methemoglobiini.
Lapsetapmise korral võib osutuda vajalikuks tuvastada vastsündinu või loote vere olemasolu erinevate füüsiliste tõendite põhjal. Kuna loote ja vastsündinu veres ja täiskasvanu veres on kõrge HbF sisaldus - HbA, eristatakse nende füüsikalis-keemiliste omaduste poolest. omadused, vastsündinu (loote) ja täiskasvanu G. on kergesti eristatavad.
Praktikas kasutatakse kõige sagedamini leeliselist denatureerimist, kuna loote nääre on leeliste toimele vastupidavam kui täiskasvanud nääre. G. muutused määratakse spektroskoopiliselt, spektrofotomeetriliselt või fotomeetriliselt.
Polüpeptiidahelate süntees toimub struktuursete ja (võimalik) regulatoorsete geenide kontrolli all. Struktuurgeenid määravad polüpeptiidahelate spetsiifilise aminohappejärjestuse, regulatoorsed geenid aga nende sünteesi kiiruse (vt Geen).
Inimestel eksisteerivad 6 tüüpi normaalseid g-ahelaid (Hbα, Hbβ, Hbγ, Hbδ, Hbε, Hbζ) kodeerivad vastavalt 6 geeni lookust (α, β, γ, δ, ε, ζ). Arvatakse, et α-ahelate jaoks võib olla kaks lookust. Lisaks avastati 5 erinevat y-ahelat, mida kodeerivad erinevad lookused. Seega võib inimesel kokku olla 7 kuni 10 paari struktuurseid geene, mis kontrollivad G sünteesi.
Arengufaaside uurimine on näidanud, et inimesel on erinevate G-de sünteesil selge ja hästi tasakaalustatud geneetiline regulatsioon.Inimese emakaelu esimesel poolel on Gl. arr. α-, γ-, ζ-, ε-ahelate lookused (viimast vaid lühiajaliselt, embrüonaalse elu algperioodil). Pärast sündi, samaaegselt gammaahela lookuse väljalülitamisega, aktiveeruvad β ja δ ahela lookused. Selle ümberlülituse tulemusena asendatakse loote hemoglobiin (HbF) täiskasvanud hemoglobiinidega - HbA, mille HbA2 on väike osa.
Ebaselged küsimused on jäänud: G. sünteesi määravate geeni lookuste paiknemine kromosoomidel, nende aheldus, ontogeneesi perioodidega seotud G. struktuursete geenide spetsiifilise aktivatsiooni ja represseerimise sõltuvus reguleerivate geenide toimest, humoraalsete tegurite (näiteks hormoonide) mõju jne.
Globiini ahelate süntees on eriline näide valkude sünteesist rakus.
Kuigi G. sünteesi reguleerimises on veel palju ebaselget, näivad peamised mehhanismid olevat need, mis kontrollivad DNA-st pärineva mRNA (messenger RNA) transkriptsiooni kiirust. Spetsiifiliselt globiini sünteesi eest vastutava DNA täpset iseloomustust ei ole saadud. 1972. aastal õnnestus aga mitmel laboril üheaegselt sünteesida G sünteesi reguleeriv geen. Seda tehti ensüümi pöördtranskriptaasi abil (vt Geenitehnoloogia).
Heemimolekuli heemiosa sünteesitakse eraldi, kasutades rida ensümaatilisi reaktsioone, alustades Krebsi tsükli aktiivsest suktsinaadist (suktsinaadist) ja lõpetades keerulise protoporfüriini ringiga, mille keskel on rauaaatom.
Valgu sünteesi käigus omandavad globiiniahelad oma iseloomuliku konfiguratsiooni ja heem “sisestatakse” spetsiaalsesse taskusse. Järgmisena moodustub tetrameeri moodustamiseks lõpetatud ahelate kombinatsioon.
Spetsiifilise DNA süntees toimub erütrotsüütide prekursorites ainult kuni ortokroomse normoblasti staadiumini. Sel perioodil luuakse globiini lõplik polüpeptiidahelate komplekt, see kombineeritakse heemiga ning moodustub igat tüüpi RNA ja vajalikud ensüümid.
G. sünteesi pärilikud häired jagunevad kahte suurde rühma:
1) nn hemoglobiini primaarstruktuuri struktuursed variandid või anomaaliad - "kvalitatiivsed" hemoglobinopaatiad nagu Hb, S, C, D, E, M, samuti ebastabiilse hemoglobiini põhjustatud haigused ja hemoglobinopaatiad, millel on suurenenud afiinsus O 2 suhtes (vt hemoglobinopaatiad),
2) seisundid, mis tekivad globiini ühe polüpeptiidahela sünteesi kiiruse halvenemise tagajärjel - "kvantitatiivsed" hemoglobinopaatiad või talasseemia (vt).
Struktuurivariantidega võib muutuda G-molekuli stabiilsus ja talitlus.Talasseemia korral võib globiini struktuur olla normaalne. Kuna mõlemat tüüpi geneetilisi defekte esineb paljudes inimpopulatsioonides, täheldatakse sageli isikuid, kes on samaaegselt heterosügootsed G. struktuurivariandi ja talasseemia suhtes. Erinevate geenide kombinatsioonid moodustavad väga keerulise hemoglobinopaatiate spektri. Mõnel juhul võivad mutatsioonid mõjutada G. sünteesi ümberlülitamise mehhanisme, mis viib näiteks loote G. sünteesi jätkumiseni täiskasvanutel. Neid seisundeid nimetatakse ühiselt loote hemoglobiini pärilikuks püsivuseks.
Fusioonivariantide hulka kuuluvad Hb Lepore, anti-Lepore ja Kenya mutandid. Tõenäoliselt tekkisid need G. struktuurianomaaliad tihedalt seotud G geenide ebavõrdse mittehomoloogse meiootilise ristumise tulemusena, mille tulemusena on näiteks Hb Lepore α-ahelad normaalsed ja teised polüpeptiidahelad sisaldavad osa δ-järjestusest ja osa β-järjestuse polüpeptiidahelatest.
Kuna mutatsioonid võivad esineda mis tahes geenides, mis määravad geenide sünteesi, võib tekkida mitmeid olukordi, kus isikud on homosügootid, heterosügootid või topeltheterosügootid ebanormaalsete geenide alleelide suhtes ühes või mitmes lookuses.
G. struktuurivariante on teada üle 200, neist on iseloomustatud üle 120 ning paljudel juhtudel on suudetud seostada G. struktuurimuutust tema anomaalse funktsiooniga. Kõige lihtsamat mehhanismi G. uue variandi tekkeks punktmutatsiooni tulemusena (ühe aluse asendamine geneetilises koodis) saab demonstreerida HbS (skeem) näitel.
Aminohapete asendamise mõju füüsikalis-keemilistele omadustele. G. molekuli omadused, stabiilsus ja funktsioon sõltuvad eelmise asendanud aminohappe tüübist ja selle asukohast molekulis. Mitmed mutatsioonid (kuid mitte kõik) muudavad oluliselt hemoglobiinimolekuli funktsiooni ja stabiilsust (HbM, ebastabiilsed hemoglobiinid, muutunud O 2 afiinsusega hemoglobiinid) või selle konfiguratsiooni ja mitmeid füüsikalis-keemilisi. omadused (HbS ja HbC).
Hemoglobiinid on ebastabiilsed
Ebastabiilsed hemoglobiinid on rühm ebanormaalseid hemoglobiine, mis on eriti tundlikud oksüdeerivate ainete, kuumuse ja mitmete muude tegurite toimele, mis on seletatav mõnede aminohappejääkide geneetiliselt määratud asendamisega nende molekulides teistega; selliste hemoglobiinide kandmine avaldub sageli hemoglobinopaatiana (vt.).
Inimeste erütrotsüütides, kes on ebastabiilse G. kandjad, nn. Heinzi kehad, mis on ebastabiilsete vererakkude denatureeritud molekulide akumulatsioonid (kaasasündinud hemolüütiline aneemia Heinzi kehadega). 1952. aastal pakkus I. A. Cathie, et see haigus on pärilik. Frick (P. Frick), Gitzig (W. H. Hitzig) ja Vetke (K. Betke) tõestasid 1962. aastal esmakordselt Hb Zürichi näitel, et Heinzi kehadega hemolüütiline aneemia on seotud ebastabiilsete hemoglobiinide olemasoluga. Carrell (R. W. Carrell) ja G. Lehmann pakkusid 1969. aastal sellistele hemoglobinopaatiatele välja uue nime - hemolüütiline aneemia, mis on põhjustatud ebastabiilse G.
Heemimolekulide ebastabiilsuse põhjuseks võib olla heemiga kokkupuutes olevate aminohappejääkide asendumine; mittepolaarse aminohappejäägi asendamine polaarsega; molekuli sekundaarse struktuuri rikkumine, mis on põhjustatud mis tahes aminohappejäägi asendamisest proliinijäägiga; aminohappejääkide asendamine α1β1- ja α2β2-kontaktide piirkonnas, mis võib viia hemoglobiini molekuli dissotsieerumiseni monomeerideks ja dimeerideks; mõne aminohappejäägi deletsioon (kadumine); subühikute pikenemine, näiteks kahel ebastabiilsel hemoglobiinil - Hb Cranstonil ja Hb Takil on normaalse hemoglobiiniga võrreldes piklikud beetaahelad tänu nende C-otsa külge kinnitatud hüdrofoobsele segmendile.
Ebastabiilsete gaaside klassifikatsioon, mille pakkus välja J. V. Dacie ja mida muutsid Yu. N. Tokarev ja V. M. Belostotski, põhineb molekulis toimuvate muutuste olemusel, mis muudavad gaasi ebastabiilseks.
Kirjeldatud u. 90 ebastabiilset G. ja variante aminohappejääkide asendamisega G. molekuli beeta-ahelates leitakse ligikaudu 4 korda sagedamini kui selliste jääkide asendamisega alfa-ahelates.
Ebastabiilse G. kandmine pärineb autosoomselt dominantselt ja kandjad on heterosügoodid. Mõnel juhul on ebastabiilse G. kandmine spontaanse mutatsiooni tagajärg. G. stabiilsuse vähenemine ei põhjusta mitte ainult selle kerget sadenemist, vaid mõnel juhul ka heemi kadu. Aminohappejääkide asendused hemoglobiini molekuli a- ja (3-ahelate) kokkupuutepunktides võivad mõjutada molekuli afiinsust hapniku suhtes, heemide vastasmõju ning tasakaalu hemoglobiini tetrameeride, dimeeride ja monomeeride vahel. inimesed heterosügootsed ebastabiilse hemoglobiini, nii normaalse kui ka ebanormaalse, ebastabiilse G. geenide suhtes, kuid viimane denatureerub kiiresti ja muutub funktsionaalselt passiivseks.
Rasket hemolüütilist aneemiat täheldatakse tavaliselt patsientidel, kes on suure molekulaarse ebastabiilsusega ebastabiilse G. kandjad.
Muu ebastabiilse G. kiilu kandmisel on ilmingud tavaliselt mõõduka raskusega või täiesti ebaolulised. Mõnel juhul (Hb Riverdale-Bronx, Hb Zurich jt) ilmneb ebastabiilse G. kandmine hemolüütiliste kriisidena pärast teatud ravimite (sulfoonamiidid, valuvaigistid jne) võtmist või kokkupuudet infektsioonidega. Mõnedel patsientidel, näiteks Hb Hammersmithi, Hb Bristoli, Hb Sydney jt kandjatel, tekib naha tsüanoos, mis on põhjustatud met- ja sulfhemoglobiinide suurenenud moodustumisest. Ebastabiilse G. kandmisest põhjustatud hemoglobinopaatiaid tuleks eristada muude etioloogiate hemolüütilistest ja hüpokroomsetest aneemiatest ning ennekõike rauapuudusest ja hemolüütilisest aneemiast, mis on seotud pentoos-fosfaadi tsükli ensüümide geneetiliselt määratud puudulikkusega, glükolüüsiga jne.
Enamik inimesi, kes on ebastabiilse G. kandjad, ei vaja erikohtlemist. Hemolüüsi korral on kasulik taastav ravi. Kõigil ebastabiilse G. kandjatel soovitatakse hoiduda oksüdeerivatest ravimitest, mis provotseerivad hemolüüsi (sulfoonamiidid, sulfoonid, valuvaigistid jne). Vereülekanne on näidustatud ainult sügava aneemia tekkega. Raske hemolüüsi korral, millega kaasneb punaste vereliblede suurenenud sekvestratsioon põrna ja hüpersplenismi poolt, on näidustatud splenektoomia (vt). Siiski ei tehta lastel (alla 6-aastastel) splenektoomiat tavaliselt septitseemia tekkeriski tõttu.
Ebastabiilsete hemoglobiinide tuvastamise meetodid
Hemoglobiini termolabiilsuse uurimine on kõige olulisem test selle ebastabiilsuse tuvastamiseks. Selle pakkusid välja A. G. Grimes ja A. Meisler 1962. aastal ning Dacey 1964. aastal ning see koosneb hemolüsaatide inkubeerimisest, mis on lahjendatud 0,1 M fosfaat- või Tris-HCl puhvriga, pH 7,4, temperatuuril 50–60 °C tund aega. Sel juhul ebastabiilsed glükosiidid denatureeritakse ja sadestuvad ning lahusesse jäänud termostabiilse hüdroksiidi kogus määratakse spektrofotomeetriliselt 541 nm juures ja arvutatakse järgmise valemi abil:
/ * 100 = = termostabiilne hemoglobiin (protsentides),
kus E on ekstinktsiooni väärtus lainepikkusel 541 nm.
Termolabiilse G. suhteline sisaldus võrdub 100% - termostabiilse G. kogus (protsentides).
Carrell ja Kay (R. Kau) tegid 1972. aastal ettepaneku inkubeerida hemolüsaate 17% isopropanool-Tris puhvri, pH 7,4, segus 37° juures 30 minutit.
Erütrotsüütide hemolüüsi võib põhjustada vesi, kuna süsiniktetrakloriidi või kloroformi kasutamine sel eesmärgil põhjustab ebastabiilsete vererakkude osalist denaturatsiooni ja saadud andmete moonutamist.
Kõige tavalisem meetod ebastabiilse G. määramiseks on histokeemiline, Heinzi kehade tuvastamise meetod. Sel juhul värvitakse punaseid vereliblesid kristallvioletiga, metüülvioletiga või kasutatakse reaktsiooni atsetüülfenüülhüdrasiiniga. Esialgu hoitakse verd 24 tundi 37° juures. Tuleb meeles pidada, et Heinzi kehasid võib leida ka teiste hemolüütiliste aneemiate, talasseemia, methemoglobiini moodustavate ainetega mürgituse ja mõnede ensümopaatiate korral.
Hemolüsaatide elektroforeetiline eraldamine paberil või tselluloosatsetaadil ei anna sageli tulemusi, kuna paljudes ebastabiilsetes hemolüsaatides ei muuda aminohappejääkide asendamine molekulis molekuli elektroforeetilisi omadusi. Selles osas on informatiivsemad elektroforees polüakrüülamiid- ja tärklisegeelides (vt Elektroforees) või isoelektriline teravustamine.
Paljudel patsientidel, kes on ebastabiilse G. kandjad, omandab uriin pidevalt või kohati tumedat värvi dipürroolide moodustumise tõttu, mis on üsna täpne märk ebastabiilse G. olemasolust erütrotsüütides.
Bibliograafia: Vladimirov G. E. ja Panteleeva N. S. Funktsionaalne biokeemia, L., 1965; Ja r ja L. I. Hemoglobiinid ja nende omadused, M., 1975, bibliogr.; Korzhuev P. A. Hemoglobiin, M., 1964, bibliogr.; Kushakovsky M. S. Hemoglobiini kahjustuse kliinilised vormid, L., 1968; Peruu TC M. Hemoglobiini molekul, raamatus: Molecules and Cells, toim. G. M. Frank, tlk. inglise keelest, lk. 7, M., 1966; t u-m ja n about in A.K. Asitõendite kohtumeditsiinilise ekspertiisi alused, M., 1975, bibliogr.; Uspenskaya V.D. Haptoglobiini sünteesi ja katabolismi kohast ning selle rollist hemoglobiini metabolismis, Vopr. kallis. keemia, kd 16, nr 3, lk. 227, 1970, bibliogr.; Harris G. Inimese biokeemilise geneetika alused, trans. inglise keelest, lk. 15, M., 1973; Sharonov Yu. A. ja Sharonova N. A. Hemoglobiini struktuur ja funktsioonid, Molecular Biol., v. 9, nr 1, lk. 145, 1975, bibliogr.; C h a g a c h e S. Muutunud hapnikuafiinsusega hemoglobiinid, Clin. Haemat., v. 3, lk. 357, 1974, bibliogr.; Giblett E. R. Geneetilised markerid inimveres, Philadelphia, 1969; Hemoglobiini ja punaste vereliblede struktuur ja funktsioon, toim. G. J. Brewer, N. Y.-L., 1972; HuehnsE. R. Hemoglobiini alfa-ahela sünteesi geneetiline kontroll, Haematologia, v. 8, lk. 61, 1974, bibliogr.; Leh-mannH. a. Hunt s m a n R. G. Man’s hemoglobins, Philadelphia, 1974; P e-r u t z M. F. Krooni loeng, 1968, Hemoglobiini molekul, Proc, roy, Soc. V., v. 173, lk. 113, 1969; P e rut z M. F* a. Lehmann H. Inimese hemoglobiini molekulaarne patoloogia, Nature (Lond.), v. 219, lk. 902, 1968; RoughtonF. J. Mõned hiljutised tööd hapniku, süsinikdioksiidi ja hemoglobiini vastastikmõjude kohta, Biochem. J., v. 117, lk. 801, 1970;S t a m a-toyannoponlos G. a. NuteP. E. Hemoglobiinide geneetiline kontroll, Clin. Haemat., v. 3, lk. 251, 1974, bibliogr.; Van Assendelft O. W. Hemoglobiini derivaatide spektrofotomeetria, Assen, 1970; Weatherall D. J. Mõnede hemoglobiinihäirete molekulaarne alus, Brit, med. J., v. 4, lk. 451, 516, 1974; Weatherall D. J. a. Clegg J. B. Talasseemia molekulaarne alus, Brit. J. Haemat., v. 31, lisa, lk. 133, 1975; Wintro-b e M. M. Clinical hematology, Philadelphia, 1974.
Hemoglobiinid on ebastabiilsed- Didkovsky N.A. jt Hemoglobiin Volga ft 27 (B9) alaniin->asparagiinhape (uus ebanormaalne hemoglobiin tõsise ebastabiilsusega), Probleemid, hematool ja ülevool, veri, kd 22, nr 4, lk. 30, 1977, bibliogr.; I d e l l-s o n L. I., Didkovski N. A. ja Ermilchenko G. V. Hemolüütilised aneemiad, M., 1975, bibliogr.; In u n n H. F., Unusta B. G. a. R a n n e y H. M. Human hemoglobins, Philadelphia, 1977, bibliogr.; Lehmann H.a. K y-n o h P. A. Inimese hemoglobiini variandid ja nende omadused, Amsterdam, 1976.
A.P. Andreeva; Yu N. Tokarev (gem. ja gen.), A. K. Tumanov (kohus); Yu. N. Tokarev, V. M. Belostotski.
Keemia põhimõisted ja seadused.
Molaarmass, aine kogus, Avogadro konstant.
Gaasi molaarmaht.
I. Aine struktuuriüksuse massi arvutamine.
Määrake vesinikuaatomite arv 9 g veeproovis.
M(H2O) = 18 g/mol
n(H2O) = 9/18 = 0,5 mol
Valemist järeldub, et 1 mool H2O sisaldab 2 mooli vesinikuaatomeid, s.o. n(H) = 2 × 0,5 mol = 1 mol.
Määrake vesinikuaatomite arv 26,4 g ammooniumvesinikfosfaadi proovis.
M(NH4)2HPO4 = 132 g/mol
n((NH4)2HPO4) = 26,4/132 = 0,2 mol
n(H) = 0,2 × 9 = 1,8 mol
Vastus: 1,8 mol
Segu koosneb etanoolist C2H5OH massiga 46 g ja veest kaaluga 72 g Määrake segus hapnikuaatomite arv.
n(C2H5OH) = 46/46 = 0,1 mol n(O) = 0,1 × 1 = 0,1 mol
n(H2O) = 72/18 = 0,4 mol n(O) = 0,4 × 1 = 0,4 mol n (O) = 0,1 + 0,4 = 0,5 mol
Segu koosneb 6 g kaaluvast äädikhappest CH3COOH ja 9,2 g sipelghappest HCOOH Määrake segus hapnikuaatomite arv.
n(CH3COOH) = 6/60 = 0,1 mol n(O) = 0,1 × 2 = 0,2 mol
n(HCOOH) = 9,2/46 = 0,2 mol n(O) = 0,2 × 2 = 0,4 mol n(O) = 0,2 + 0,4 = 0,6 mol
Määrake 12,04 1022 veemolekuli sisaldava veeproovi mass.
n(H2O) = NNA = 12,04∙10226,02∙1023 = 0,2 mol
m(H2O) = 0,2 × 18 = 3,6 g
Määrake 6,021022 vaseaatomit sisaldava vasksulfaadi proovi mass.
Vastus: 16
Arvutage 3,011022 vesinikuaatomit sisaldava ammooniumsulfaadi proovi mass.
n(H) =NNA = 3,0110226,02∙1023 = 0,05 mol
ühendis on 8 hapnikuaatomit
n(NH4)2SO4 = 0,05 /8 = 0,00625 mol
m = 0,00625 × 132 g\mol = 0,825 g.
Määrake magneesiumvesiniksulfaadi proovi mass, kui on teada, et see sisaldab 3,6121023 hapnikuaatomit.
n(O) =NNA = 3,612 × 10236,02 × 1023 = 0,6 mol
n Mg(HS04)2 = 0,6/8 = 0,075 mol
m = 0,075 × 218 = 16,35 g
Määrake naatriumsulfaadi lahuse mass vees, mis sisaldab 30,1 1022 naatriumi aatomit ja 6,021 024 vesinikuaatomit.
n (Na) =NNA = 30,1∙10226,02∙1023 = 0,5 mol
valem sisaldab 2 naatriumi aatomit, seega: n(Na2SO4) = 0,5/2 = 0,25 mol
m ainet (Na2SO4) = 0,25 × 142 g\mol = 35,5 g
n(H) =NNA = 6,02∙10246,02∙1023 = 10 mol
n(H2O) = 10/2 = 5 mol
m(H2O) = 5 × 18 = 90 g
m lahus = m ainet (Na2 SO4) + m (H2O) = 35,5 + 90 = 125,5 g.
Määrake etanooli C2H5OH lahuse mass vees, mis sisaldab 12,04 1022 süsinikuaatomit ja 24,08 1022 hapnikuaatomit.
n (C) =NNA = 12,04∙10226,02∙1023 = 0,2 mol
n (C2H5OH) = 0,2/2 = 0,1 mol
m(C2H5OH) = 0,1 × 46 = 4,6 g
n(O) =NNA = 2,405∙10236,02∙1023 = 0,4 mol
n(H2O) = 0,4/1 = 0,4 mol
m(H2O) = 0,4 × 18 = 7,2 g
mlahus = m aine + m(H2O) = 4,6 + 7,2 = 11,8 g
Arvutage ühe naatriumi aatomi mass.
ma = M (Na) / NA = 23 / 6,021023 = 3,8210-23 g.
Leidke kolme kaltsiumi aatomi mass.
ma = 3 M (Ca) / NA = (3 × 40) / 6,021023 = 19,910-23 g
Arvutage 7 veemolekuli mass.
ma = 7 M (H2O) / NA = (7 × 18) / 6,021023 = 20,910-23 g
Määrake ühe SO3 molekuli mass
ma = M (SO3) / NA = 80 / 6,021023 = 13,3 10-23 g
Arvutage räni(IV)oksiidi viie valemiühiku mass (g).
mfe=5×Mr×u=5×60×1,66∙10–27=4,98∙10–22 g.
Arvutage mass:
Naatriumi aatom (g)
ma = M (Na) / NA = 23 / 6,021023 = 3,8210-23 g
ma=ArNa×u=23×1,6610–27 = 3,8210–23 g
Viis molekuli valget fosforit P4 (kg)
Vastus: 1,02910-24 kg
Kümme rombse väävli S8 molekuli (g)
Vastus: 4,2510-21 g
Kolm osooni molekuli O3 (amü)
ma=3×16×3×a.u.m=144a.u.m.
Fullereeni molekulid C60 (mg)
mm = Mr(C60) × u = 1195,210-27 = 1,19510-24 kg = 1,19510-21 g = 1,195 10-18 mg
Kolm kofeiini molekuli С8Н10O2N4 (kg)
Vastus: 9,6610-25 kg
Ammooniumkatioon (g)
ma = Mr(NH4+) × u = 18 × 1,6610-27 = 2,9910-23 g
Anioon SO42 (g)
Vastus: 1,5910-22 g.
Hemoglobiini molekulid С2954H4516N780O806S12Fe4 (mg)
Vastus: 1,0710-16 mg
Naatriumkloriidi valemiühik (g)
Kuus kaaliumhüdroksiidi valemiühikut (kg)
Baariumoksiidi kolm valemiühikut (g)
Väävlimolekuli mass võrdub kaheksa hapnikuaatomi massiga. Mitu väävliaatomit on selle molekulis?
maO=(8×16)×1,6610–27=2,12∙10–26 g
Kujutagem siis ette molekuli koostist kui Sx
X = aatomi molekulid = 2,12∙10-26Ar∙u = 2,12∙10-2632 × 1,66∙10-27 = 4 aatomit
Mitu korda on sahharoosi molekuli C12H22O11 mass suurem valge fosfori P4 molekuli massist (vastus: 2,76 korda)
Metaani CH4 ja hapniku proovid sisaldavad sama palju molekule. Leidke hapniku massi ja metaani massi suhe (vastus: 2)
Magneesiumi proovis on teemandis kolm korda rohkem süsinikuaatomeid. Arvutage magneesiumiproovi massi ja teemandiproovi massi suhe (vastus: 6)
II. Arvutused aine keemilise koguse mõistet kasutades.
Arvutage kemikaali kogus:
Vesinik portsjonis, mis sisaldab 3,01 1024 H2 molekuli
n (H2) =NNA = 3,01∙10246,02∙1023 = 5 mol
Lämmastikku 5,6 dm3 portsjonis (vastus: 0,25 mol)
Naatriumsulfaat proovis, mis kaalub 14,2 g (vastus: 0,1 mol)
Aine molekuli mass on 1,0610-22 g Arvutage aine molaarmass.
M = ma × NA = 1,06∙10-22 × 6,02 × 1023 = 64 g\mol
Määrake molekulide arv näidatud ainete osades:
3,25 mol O2 (vastus: 1,961024)
11,5 mol H2 (vastus: 6,921024)
40 mol NH3 (vastus: 2,411025)
0,0125 mol H2O (vastus: 7,521021)
Arvutage keemiline kogus näidatud ainete osades:
3,921023 O2 molekuli (vastus: 0,651 mol)
14,7 1024 argooni aatomit (vastus: 24,4 mol)
2,451023 valemiühikut Na3PO4 (vastus: 0,407 mol)
17,34 1024 H2SO4 molekuli (vastus: 28,8 mol)
Arvutage näidatud ainete osade keemiline kogus:
5,6 dm3 heelium (vastus: 0,25 mol)
1,12 dm3SO2 (vastus: 0,05 mol)
5 m3 NH3 (vastus: 2,23102 mol)
300 cm3 HCl (vastus: 1,3410-2 mol)
Määrake näidatud ainete osade mahud:
3,2 mol H2S (dm3) (vastus: 71,7 dm3)
0,05 mol CH4 (cm3) (vastus: 1120 cm3)
300 mol O2 (m3) (vastus: 6,72 m3)
1,14 mol argooni (dm3) (vastus: 25,5 dm3)
Arvutage 1,12 1023 molekuli sisaldava lämmastikuosa maht (dm3).
n(H2) =NNA = 1,12∙10236,02∙1023 = 0,18 mol
V (H2) = 0,18 × 22,4 = 4 dm3
Arvutage 2 kg hapniku portsjoni maht (vastus: 1400 dm3)
Arvutage molekulide arv ammoniaagi portsjonis mahuga 3,45 dm3 (vastus: 9,271022)
Arvutage 5,43 1024 molekuli sisaldava ammoniaagi portsjoni mass. (vastus: 153 g).
Peale selle, et .com-i domeenid on meeldejäävad, on need ainulaadsed: see on ainus omataoline .com-i nimi. Muud laiendused suunavad tavaliselt liiklust oma .com-i kolleegidele. Lisateabe saamiseks esmaklassilise .com domeeni hindamiste kohta vaadake allolevat videot:
Turbotage oma veebisaiti. Vaadake meie videot, et teada saada, kuidas.
Parandage oma veebis kohalolekut
Olge veebis märgatud suurepärase domeeninimega
73% kõigist veebis registreeritud domeenidest on .com-id. Põhjus on lihtne: .com on koht, kus toimub suurem osa veebiliiklusest. Esmaklassilise .com-i omamine annab teile suuri eeliseid, sealhulgas parema SEO, nimetuvastuse ja teie saidile autoriteetse tunde.
Siin on, mida teised räägivad
Alates 2005. aastast oleme aidanud tuhandetel inimestel saada ideaalse domeeninime
- Rääkisin Ryaniga telefoni teel ja ta aitas mind kõigis küsimustes! Suurepärane klienditeenindus ja kergesti kättesaadav. Protsess oli lihtne ja suhteliselt kiire ning toimus vaid kolme tööpäeva jooksul. Soovitan väga neile, kes kaaluvad domeeni ostmist saidilt hugedomains.com. Kaasatakse kolmas osapool nimega namebright.com, kuid lisatasu pole ja nad hõlbustavad domeenide ülekandmist serveritest. Tervist - Sammy Lam, 14.10.2019
- Ausalt öeldes enne domeeni ostmist saidilt HugeDomains.com olin ma väga hirmul, kui lugesin mõnelt veebisaidilt negatiivset arvustust, kuid otsustasin kasutada võimalust. Pärast ostmist olin üllatunud, see oli uskumatu, et mu domeeninime ostmine õnnestus ja parim osa oli see, et kandsin selle üle teise registripidaja juurde ja jällegi hugggggeeee üllatus, sest minu domeeninimi kantakse üle 30 minuti jooksul. Kogu aeg, mis kulus ostust üleandmiseni, oli vähem kui 2 tundi... Liiga suur tänu HugeDomain.com-ile ja NameBright.com-ile - Sandip Rajput, 14.10.2019
- Kiire ja sujuv tehing ja ülekanne. Võib soovitada! - Tom, 10.12.2019
- Rohkem