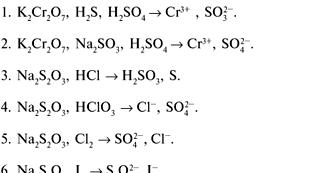Окисление аминокислот реакция. Общие пути распада аминокислот. Витамины В12 и В6
Основная часть аминокислот, которые образуются в кишечнике из белков, поступает в кровь (95%) и небольшая часть — в лимфу. По воротной вене аминокислоты попадают в печень, где расходуются на биосинтез различных специфических белков (альбуминов, глобулинов, фибриногена). Другие аминокислоты током крови разносятся ко всем органам и тканям, транспортируются внутрь клеток, где они используются для биосинтеза белков.
Неиспользованные аминокислоты окисляются до конечных продуктов обмена. Процесс расщепления тканевых белков катализируется тканевыми ферментами – протеиназами — катепсинами (часто их называют тканевыми протеазами).
Соотношение между аминокислотами в белках, которые распадаются и синтезируются, разное, поэтому часть свободных аминокислот должна быть преобразована в другие аминокислоты или окислена до простых соединений и выведена из организма.
Итак, в организме существует внутриклеточный запас аминокислот, которые в значительной мере пополняется за счет процессов взаимопревращения аминокислот, гидролиза белков, синтеза аминокислот и поступления их из внеклеточной жидкости. В то же время благодаря синтезу белков и другим реакцям (образование мочевины, пуринов и т.п.) постоянно происходит удаление свободных аминокислот из внеклеточной жидкости.
Пути обмена аминокислот в тканях.
В основе различных путей обмена аминокислот лежат три типа реакций: по аминной и карбоксильной группам и по боковой цепи. Реакции по аминной группе включают процессы дезаминирования, переаминирования, аминирования , по карбоксильной группе — декарбоксилирование. Безазотистая часть углеродного скелета аминокислот подвергается различным превращениям с образованием соединений, которые затем могут включаться в цикл Кребса для дальнейшего окисления.
Пути внутриклеточного превращения аминокислот сложны и перекрещиваются со многими другими реакциями обмена, в результате чего промежуточные продукты обмена аминокислот могут служить необходимыми предшественниками для синтеза различных компонентов клеток и быть биологически активными веществами.
Катаболизм аминокислот у млекопитающих (и у человека) происходит, в основном, в печени и немного слабее в почках.
Дезаминирование аминокислот.
Суть дезаминирования заключается в расщеплении аминокислот под действием ферментов на аммиак и безазотистый остаток (жирные кислоты, оксикислоты, кетокислоты). Дезаминирование может идти в виде восстановительного, гидролитического, окислительного и внутримолекулярного процессов. Последние два типа превалируют у человека и животных.
Окислительное дезаминирование подразделяется на две стадии. Первая стадия является ферментативной, она заканчивается образованием неустойчивого промежуточного продукта – иминокислоты (карбоновые кислоты, содержащие иминогруппу (=NH), которая во второй стадии спонтанно в присутствии воды распадается на аммиак и aльфа-кетокислоту. Ферменты, которые катализируют этот процесс, содержат в качестве простетической группы (органические соединение небелковой природы) НАД (никотинамидадениндинуклеотид) или ФАД (флавинадениндинуклеотид).
В организме человека наиболее активно протекает дезаминирование глутаминовой кислоты под действием фермента глутаматдегидрогеназы , которая находится в митохондриях клеток всех тканей. В результате этого процесса образует альфа-кетоглутаровая кислота, которая участвует во многих процессах обмена веществ.
Трансаминирование (переаминирование) аминокислот.
Обязательным условием трансаминирования является участие дикарбоновых аминокислот (глутаминовой и аспарагиновой), которые в виде соответствующих им кетокислот — альфа-кетоглутаровой и щавелевоуксусной могут взаимодействовать со всеми аминокислотами, за исключением лизина, треонина и аргинина.
При переаминировании происходит непосредственный перенос аминогруппы с аминокислоты на кетокислоту, а кетогруппы — с кетокислоты на аминокислоту без освобождения при этом аммиака. Этот процесс протекает в несколько этапов. Реакцию катализируют ферменты, относящиеся к классу трансфераз, их простетической группой является фосфорпиридоксаль-фосфорный эфир витамина В 6 . Процесс переаминирования широко распространен в живой природе. Его особенность — легкая обратимость.
Реакции переаминирования играют большую роль в обмене веществ. От них зависят такие важнейшие процессы, как биосинтез многих заменимых аминокислот из соответствующих им кетокислот, распад аминокислот, объединение путей углеводного и аминокислотного обмена, когда из продуктов распада глюкозы, например, пировиноградной кислоты, может образоваться аминокислота аланин и наоборот.
Восстановительное аминирование.
Этот процесс противоположен дезаминированию. Он обеспечивает связывание аммиака кетокислотами с образованием соответствующих аминокислот. Восстановительное аминирование катализируется хорошо функционирующей ферментной системой, обеспечивающей аминирование aльфа-кетоглутаровой или щавелевоуксусной кислоты с образованием глутаминовой или аспарагиновой кислоты.
При обезвреживании аммиака неорганическими и органическими кислотами происходит образование аммонийных солей. Этот процесс осуществляется в почках. Образовавшиеся аммонийные соли выводятся из организма с мочой и потом.
Декарбоксилирование аминокислот.
Процесс декарбоксилирования катализируется декарбоксилазами, специфическими для каждой аминокислоты, простетической группой которых служит пиридоксальфосфат. Эти ферменты относятся к классу лиаз. Процесс декарбоксилирования, который заключается в отщеплении от аминокислот СО 2 с образованием аминов, можно показать на следующей схеме:

Механизм реакции декарбоксилирования аминокислот согласно общей теории пиридоксалевого катализа сводится к образованию пиридоксальфосфат-субстратного комплекса в активном центре фермента.
Таким путем из триптофана образуется триптамин, из гидрокситриптофана — серотонин. Из аминокислоты гистидина образуется гистамин . Из глутаминовой кислоты при декарбоксилировании образуется гамма-аминомасляная кислота (ГАМК) .
Амины, образованные из аминокислот, называют биогенными аминами, так как они оказывают на организм мощный биологический эффект. Биогенные амины проявляют физиологическое действие в очень малых концентрациях. Так, введение в организм гистамина приводит к расширению капилляров и повышению их проницаемости, сужению крупных сосудов, сокращению гладких мышц различных органов и тканей, повышению секреции соляной кислоты в желудке. Кроме того, гистамин участвует в передаче нервного возбуждения.
Серотонин способствует повышению кровяного давления и сужению бронхов; его малые дозы подавляют активность центральной нервной системы, в больших дозах это вещество оказывает стимулирующее действие. В различных тканях организма большие количества гистамина и серотонина находятся в связанной, неактивной форме. Биологическое действие они проявляют только в свободной форме.
Гамма-аминомасляная кислота (ГАМК) накапливается в мозговой ткани и представляет собой нейрогуморальный ингибитор-медиатор торможения центральной нервной системы.
Большие концентрации этих соединений могут представлять угрозу для нормального функционирования организма. Однако в животных тканях имеется аминоксидаза , расщепляющая амины до соответствующих альдегидов, которые потом превращаются в жирные кислоты и распадаются до конечных продуктов.
«Обмен аминокислот в тканях» — это третья статья из цикла «Обмен белков в организме человека». Первая статья – «Расщепление белков в пищеварительном тракте ». Вторая статья «
У человека основным способом дезаминирования является окислительное дезаминирование . Выделяют два варианта окислительного дезаминирования: прямое и непрямое .
Прямое окислительное дезаминирование
Прямое дезаминирование катализируется одним ферментом, в результате образуется NH 3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное ) и не нуждаться в кислороде (анаэробное ).
1. Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы ) в качестве кофермента использующими ФАД , и оксидазами L-аминокислот (L-оксидазы ) с коферментом ФМН . В организме человека эти ферменты присутствуют, но практически неактивны.
Реакция, катализируемая оксидазами D- и L-аминокислот
2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой , превращающей глутамат в α-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных). Этот тип дезаминирования теснейшим образом связан с аминокислот и формирует с ним процесс трансдезаминирования (см ниже).

Реакция прямого окислительного дезаминирования
глутаминовой кислоты
Непрямое окислительное дезаминирование (трансдезаминирование)
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH 2 -группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты при участии ферментов аминотрансфераз . Этот перенос называется и его механизм довольно сложен.
В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется α-кетоглутаровая кислота , которая превращается в глутамат ("аминокислота 2").

Схема реакции трансаминирования
В результате трансаминирования свободные аминокислоты теряют α-NH 2 -группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО 2 и Н 2 О.
При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться в печени для синтеза глюкозы в глюконеогенезе . В этом случае количество аминотрансфераз в гепатоците увеличивается под влиянием глюкокортикоидов .
Второй этап состоит в отщеплении аминогруппы от аминокислоты 2 – дезаминирование .
Т.к. в организме коллектором всех аминокислотных аминогрупп является глутаминовая кислота , то только она подвергается окислительному дезаминированию с образованием аммиака и α-кетоглутаровой кислоты. Этот этап осуществляется глутаматдегидрогеназой , которая имеется в митохондриях всех клеток организма, кроме мышечных.
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование .

Схема обоих этапов трансдезаминирования
Если реакция прямого дезаминирования идет в митохондриях печени, аммиак используется для синтеза мочевины , которая в дальнейшем удаляется с мочой. В эпителии канальцев почек реакция необходима для удаления аммиака в процессе аммониегенеза .
Так как НАДН используется в дыхательной цепи и α-кетоглутарат вовлекается в реакции ЦТК, то реакция активируется при дефиците энергии и ингибируется избытком АТФ и НАДН .
Роль трансаминирования и трансдезаминирования
Реакции трансаминирования :
- активируются в печени, мышцах и других органах при поступлении в клетку избыточного количества тех или иных аминокислот – с целью оптимизации их соотношения,
- обеспечивают синтез заменимых аминокислот в клетке при наличии их углеродного скелета (кетоаналога),
- начинаются при прекращении использования аминокислот на синтез азотсодержащих соединений (белков, креатина, фосфолипидов, пуриновых и пиримидиновых оснований) – с целью дальнейшего катаболизма их безазотистого остатка и выработки энергии,
- необходимы при внутриклеточном голодании, например, при гипогликемиях различного генеза – для использования безазотистого остатка аминокислот в печени для
Большую часть энергии организм получает в результате окисления углеводов и нейтральных жиров (до 90 %). Остальную часть ~ 10% за счет окисления аминокислот. Аминокислоты, прежде всего, используются для синтеза белка. Окисление их происходит:
1) если аминокислоты, образующиеся при обновлении белков не используются для синтеза новых белков;
2) если в организм поступает избыток белка;
3) в период голодания или при сахарном диабете, когда нет углеводов или их усвоение нарушено, в качестве источника энергии используются аминокислоты.
Во всех этих ситуациях аминокислоты теряют свои аминогруппы и превращаются в соответствующие α-кетокислоты, которые затем окисляются до СО 2 и H 2 O. Частично это окисление идет через цикл трикарбоновых кислот. В результате дезаминирования и окисления образуются пировиноградная кислота, ацетил-КоА, ацетоацетил-КоА, α-кетоглутаровая кислота, сукцинил-КоА, фумаровая кислота. Некоторые аминокислоты могут превращаться в глюкозу, а другие – в кетоновые тела.
Пути обезвреживания аммиака в тканях животных
Аммиак токсичен, и накопление его в организме может привести к смерти. Существуют следующие пути обезвреживания аммиака:
1. Синтез аммонийных солей.
2. Синтез амидов дикарбоновых аминокислот.
3. Синтез мочевины.
Синтез аммонийных солей происходит ограниченно в почках, это как дополнительное защитное приспособление организма при ацидозах. Аммиак и кетокислоты частично используются для ресинтеза аминокислот и для синтеза других азотистых веществ. Кроме того, в тканях почек аммиак участвует в процессе обезвреживания оргинических и неорганических кислот, образуя с ними нейтральные и кислые соли:
R – COOH + NH 3 → R – COONH 4 ;
H 2 SO 4 + 2 NH 3 → (NH 4) 2 SO 4 ;
H 3 PO 4 + NH 3 → NH 4 H 2 PO 4
Этим путем организм защищается от потери с мочой при выведениикислот знпачительного количества катионов (Na, K, отчасти Са, Mg), что могло бы привести к резкому снижению щелочного резерва крови. Количество аммонийных солей, выводимых с мочой, заметно повышается при ацидозе, так как аммиак используется для нейтрализации кислоты. Одним из путей связывания и обезвреживания аммиака является использование его для образования амидной связи глутамина и аспарагина. При этом из глутаминовой кислоты под действием фермента глутаминсинтетазы синтезируется глутамин, из аспарагиновой кислоты при участии аспарагинсинтетазы – аспарагин:
Этим путем происходит устранение аммиака во многих органах (мозг, сетчатка, почки, печень, мышцы). Амиды глутаминовой и аспарагиновой кислот могут образоваться и тогда, когда эти аминокислоты находятся в структуре белка, то есть акцептором аммиака может быть не только свободная аминокислота, но и белки, в состав которых они входят. Аспарагин и глутамин доставляются в печень и используются в синтезе мочевины. Аммиак переносится в печень и с помощью аланина (глюкозо-аланиновый цикл). Этот цикл обеспечивает перенос аминогрупп из скелетных мышц в печень, где они превращаются в мочевину, а работающие мышцы получают глюкозу. В печени глюкоза синтезируется из углеродного скелета аланина. В работающей мышце из α-кетоглутаровой кислоты образуется глутаминовая кислота, которая затем передает аминную группу - NH 2 пировиноградной кислоте, в результате синтезируется аланин – нейтральная аминокислота. Схематически указанный цикл выглядит следующим образом:
Глутаминовая кислота + пировиноградная кислота ↔
↔ α-кетоглутаровая кислота + аланин
 Рис.
10.1. Глюкозо-аланиновый цикл.
Рис.
10.1. Глюкозо-аланиновый цикл.
Этот цикл выполняет две функции: 1) переносит аминогруппы из скелетных мышц в печень, где они превращаются в мочевину;
2) обеспечивает работающие мышцы глюкозой, поступающей с кровью из печени, где для ее образования используется углеродный скелет аланина.
Образование мочевины – основной путь обезвреживания аммиака. Этот процесс изучали в лаборатории И.П.Павлова. Показано, что мочевина синтезируется в печени из аммиака, CO 2 и воды.
Мочевина выводится с мочой в качестве главного конечного продукта белкового, соответственно аминокислотного обмена. На долю мочевины приходится до 80-85% всего азота мочи. Главным местом синтеза мочевины в организме является печень. Сейчас доказано, что синтез мочевины происходит в несколько этапов.
1 стадия – образование карбамоилфосфата происходит в митохондриях под действием фермента карбомоилфосфат-синтетазы:

На следующей стадии с участием орнитина синтезируется цитруллин:

Цитруллин переходит из митохондрий в цитозоль клеток печени. После этого в цикл вводится вторая аминогруппа в форме аспарагиновой кислоты. Происходит конденсация молекул цитруллина и аспарагиновой кислоты с образованием аргинин-янтарной кислоты.

Цитруллин аспарагиновая аргинин-янтарная
кислота кислота
Аргинин-янтарная кислота расщепляется на аргинин и фумаровую кислоты.

Под действием аргиназы аргинин гидролизуется, образуется мочевина и орнитин. В дальнейшем орнитин поступает в митохондрии и может включиться в новый цикл обезвреживания аммиака, а мочевина выделяется с мочой.

Таким образом, в синтезе одной молекулы мочевины нейтрализуется две молекулы NH 3 и CO 2 (HCO 3), что также имеет значение в поддержании рН. Для синтеза одной молекулы мочевины расходуется 3 молекулы АТФ, в том числе две при синтезе карбомоилфосфата, одна для образования аргинин-янтарной кислоты; фумаровая кислота может превращаться в яблочную и щавелевоуксусную кислоты (цикл Кребса), а последняя в результате трансаминирования или восстановительного аминирования может превратиться в аспарагиновую кислоту. Некоторая часть азота аминокислот выделяется из организма в виде креатинина, который образуется из креатина и креатинфосфата.
Из всего азота мочи на долю мочевины приходится до 80-90%, аммонийных солей – 6 %. При избыточном кормлении белком доля азота мочевины возрастает, а при недостаточном белковом кормлении снижается до 60 %.
У птиц и рептилий – нейтрализация аммиака происходит путем образования мочевой кислоты. Птичий помет на птицефабриках - это источник азотсодержащего удобрения (мочевая кислота).
Окислительно-восстановительные процессы, протекающие с участием аминокислот.
Эти процессы протекают в организмах растений и животных. Имеются такие соединения, которые способны либо выделять водород, либо поглощать его (присоединять). При биологическом окислении идет отщепление двух атомов водорода, а при биологическом восстановлении - присоединение двух томов водорода. Рассмотрим это на примере цистеина и цистина.
HS NH 2 OH -2H S NH 2 OH
HS NH 2 OH +2H S NH 2 OH
CH 2 - CH - C = O CH 2 - CH - C = O
цистеин цистин
восстановленная форма окисленная форма
Две молекулы цистина, теряя два атома водорода, образуют окисленную форму - цистеин. Этот процесс обратимый, при присоединении двух атомов водорода к цистину образуется цистеин - восстановленная форма. Аналогично протекает процесс окислительно- восстановительный на примере трипептида - глутатиона, который состоит из трех аминокислот: глутаминовой, глицина и цистеина.
O = C - NH - CH - CH 2 - SH O = C - NH - CH - CH 2 - S - S -CH 2 - CH - NH - C = O
CH 2 C = O -2Н CH 2 C = O C = O CH 2
CH 2 NH +2Н CH 2 NH NH CH 2
CH - NH 2 CH 2 глицин CH - NH 2 CH 2 CH 2 CH - NH 2
C = O C = O C = O C = O C = O C = O
OH OH OH OH OH OH
(2 молекулы)
трипептид восстановленная форма гексапептид - окисленная форма
При окислении отщепляется 2 атома водорода и соединяются две молекулы глутатиона и трипептид превращается в гексапептид, то есть окисляется.
Все химические реакции можно разделить на два типа. К первому из них относятся реакции, протекающие без изменения степени окисления атомов, входящих в состав реагирующих веществ, например: = = Как видно...
Виды химических реакций, их использование в промышленности
Трудно переоценить значение металлов для народного хозяйства, а получение металлов из руд также основано на окислительно-восстановительных реакциях. Обычно руды состоят из кислородных или сернистых соединений...
Кинетика фотохимических реакций
Молекулы реагирующего вещества под действием света обычно переходят в электронно-возбужденное состояние...
Кинетика химических реакций
Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Окисление-восстановление -- один из важнейших процессов природы. Дыхание...
Колебательные химические реакции
Существуют многочисленные критерии классификации химических реакций. Один из важнейших - признак изменения степеней окисления элементов. В зависимости от того, изменяются степени окисления элементов или сохраняются...
Мир солей
Поскольку соли состоят из ионов металла и кислотного остатка, их окислительно-восстановительные реакции условно можно разбить на две группы: реакции за счет иона металла и реакции за счет кислотного остатка...
Окислительно-восстановительная реакция
Окислительно-восстановительные реакции, химические реакции, сопровождающиеся изменением окислительных чисел атомов. Первоначально (со времени введения в химию кислородной теории горения А. Лавуазье,конец 18 в...
Опыт 1. Если прикоснуться горящей спичкой к кучке оранжево-красных кристаллов дихромата аммония (NH4)2Cr2O7, произойдет нечто примечательное: начинается «извержение» маленького «вулкана»...
Окислительно-восстановительные реакции
Опыт 1. При добавлении к глюкозе раствора перманганата калия, подкисленного серной кислотой...
Окислительно-восстановительные реакции
Все процессы в живой природе сопровождаются превращением энергии и ее переходами из одной формы в другую. В течение одного дня взрослый человек потребляет примерно 10 млн. Дж энергии...
Определение содержания азота в стали
В этом пункте описываются процессы, которые происходят в пневматическом блоке в процессе измерения. Протекание измерения. После того...
Основы химии
1. Цель работы: Формирование навыков составления уравнений окислительно-восстановительных реакций, расчета эквивалентных масс окислителя и восстановителя, определения направления протекания окислительно-восстановительных реакций. 2...
Расчет основных показателей экстракции в системе жидкость - жидкость
Разделение веществ в процессе экстракции основано на различии в распределении между двумя несмешивающимися жидкостями. В простейшем случае...
Химические свойства олова и его соединений
Мерой окислительно-восстановительной способности веществ служат их окислительно-восстановительные (электродные) потенциалы (ц0)...
Химия каренов
Радикальные перегруппировки монотерпеноидов каранового ряда происходят, как правило, при фотохимических реакциях. Фотохимические превращения таких соединений достаточно подробно описаны в обзоре 12...
Большую часть метаболической энергии, вырабатываемой в тканях, поставляют процессы окисления углеводов и триацилглицеролов; у взрослого мужчины до 90% всей потребности в энергии покрывается из этих двух источников. Остальную энергию (в зависимости от рациона от 10 до 15%) дает окисление аминокислот.
Хотя роль аминокислот в организме определяется в первую очередь тем, что они служат строительными блоками для биосинтеза белков, в известных условиях они могут претерпевать и окислительное расщепление. Это возможно в трех случаях. 1) Если аминокислоты, высвобождающиеся при обычном динамическом обновлении белков, не используются для синтеза новых белков, то они подвергаются окислительному расщеплению. 2) Если организм получает с пищей больше аминокислот, чем это ему необходимо для белкового синтеза, то избыточное их количество расщепляется, потому что аминокислоты не откладываются в организме в запас. 3) Во время голодания или при сахарном диабете, т.е. тогда, когда углеводов нет или когда их утилизация нарушена, в качестве топлива используются белки. Во всех этих ситуациях аминокислоты теряют свои аминогруппы и превращаются в соответствующие -кетокислоты, которые затем окисляются до и воды; частично это окисление идет через цикл лимонной кислоты.
В этой главе мы познакомимся с метаболическими путями, по которым идет окислительное расщепление двадцати обычных аминокислот, входящих в состав белков. Мы узнаем также, что у разных видов животных отщепляемый от аминокислот аммиак выводится из организма в различной химической форме.
19.1. Перенос а-аминогрупп катализируется трансаминазами
Аминогруппы двадцати обычных -аминокислот, обнаруживаемых в белках, отщепляются на одной из стадий окислительного расщепления аминокислот. Если эти аминогруппы не используются повторно для синтеза новых аминокислот или других азотсодержащих соединений, то они собираются в одной форме, превращаются в конце концов в один общий конечный продукт и в таком виде выводятся из организма. У человека и у большинства других наземных позвоночных таким конечным продуктом является мочевина. Отщепление -аминогрупп от большей части L-аминокислот катализируется ферментами, которые называются трансаминазами или аминотрансферазами. В таких ферментативных реакциях трансаминирования -аминогруппа переносится от аминокислоты на -углеродный атом -кетоглутарата, в результате чего образуется -кетоаналог исходной аминокислоты и -глутамат, представляющий собой продукт аминирования -кетоглутарата (рис. 19-1).

Рис. 19-1. Реакция трансаминирования. Переносимая аминогруппа выделена красным. В большей части реакций трансаминирования акцептором аминогрупп служит -кетоглутарат.
Отметим, что реального дезаминирования, т.е. потери аминогрупп, в таких реакциях не происходит, поскольку дезаминирование -аминокислоты сопровождается аминированием -кетоглутарата. Смысл трансаминирования состоит в его коллекторной функции, иными словами, в том, что аминогруппы от многих разных аминокислот собираются в одной форме в виде -глутаминовой кислоты. Таким образом, катаболизм различных аминокислот приводит в конечном итоге к одному единственному продукту.
Большинство трансаминаз проявляет специфичность в отношении акцептора аминогрупп: таким акцептором в приведенной выше реакции служит для них -кетоглутарат. Менее специфичны трансаминазы в отношении другого субстрата, т.е. той аминокислоты, которая играет роль донора аминогрупп. Ниже приведено несколько реакций, в которых участвуют наиболее важные трансаминазы (в названии ферментов указывается аминокислота, играющая роль донора аминогрупп):

Итак, общим акцептором, принимающим аминогруппу от большинства аминокислот, является -кетоглутарат. Образовавшийся -глутамат служит для того, чтобы направлять аминогруппы на определенные биосинтетические пути (гл. 22) и в ту конечную последовательность реакций, посредством которой образуются продукты азотистого обмена, выводимые затем из организма. Реакции, катализируемые трансаминазами, легко обратимы, поскольку их константы равновесия близки к 1,0. Это означает, что величина для таких реакций близка к нулю (разд. 14.3).
У всех трансаминаз имеется прочно связанная простетическая группа, и механизм их действия одинаков. Простетической группой трансаминаз служит пиридоксальфосфат - производное пиридоксина, или витамина (разд. 10.8). Пиридоксальфосфат действует как промежуточный переносчик аминогрупп в активном центре трансаминаз (рис. 19-2).

Рис. 19-2. Простетическая группа трансаминаз. Пиродоксальфосфат и его аминированная форма - пиридоксаминфосфат (Б) - это прочно связанные коферменты трансаминаз. Функциональные группы, от которых зависит их действие, показаны на красном фоне. В. Пиридоксальфосфат играет роль промежуточного переносчика аминогрупп при действии трансаминаз. Е означает здесь ферментный белок, а - прочно связанный пиридоксальфосфат. Трансаминазы катализируют бимолекулярные реакции, протекающие по механизму типа «пинг-понг». Первый субстрат - отдав свою аминогруппу, покидает фермент в виде -кетокислоты до того, как к ферменту присоединится второй
Во время каталитического цикла он претерпевает обратимые переходы между альдегидной формой (пиридоксальфосфат), способной присоединять аминогруппы, и аминированной формой (пиридоксаминфосфат), способной передавать аминогруппы на -кетоглутарат. Таким образом, эта простетическая группа действует как обратимый переносчик аминогрупп от -аминокислоты на -кетоглутарат (рис. 19-2). Трансаминазы - классический пример ферментов, катализирующих бимолекулярные реакции, протекающие по механизму типа «пинг-понг» (разд. 9.8). В таких реакциях первый субстрат должен уйти из активного центра фермента до того, как второй субстрат сможет к нему присоединиться. Сначала с активным центром фермента связывается приходящая аминокислота, которая отдает свою аминогруппу пиридоксальфосфату и в форме -кетокислоты покидает активный центр. Затем с активным центром связывается приходящая -кетокислота; она принимает аминогруппу от пиридоксаминфосфата и отделяется от активного центра, теперь уже в форме аминокислоты.
На рис. 19-3 видно, что карбонильная группа связанного с ферментом пиридоксальфосфата взаимодействует с -амино-группой приходящей аминокислоты, в результате чего образуется промежуточный продукт, представляющий собой ковалентное соединение - шиффово основание.

Рис. 19-3. Схема, поясняющая действие пиридоксальфосфата в трансаминазах. Аминогруппа приходящей -аминокислоты (А) взаимодействует с карбонильной группой пиридоксальфосфата, прочно связанного с ферментом. При этом в качестве промежуточного продукта образуется шиффово основание (Б), которое переходит затем в свою таутомерную форму (В). Последняя гидролизуется с образованием соответствующей -кетокислоты, которая удаляется, в то время как аминогруппа остается ковалентно связанной с трансаминазой в форме пиридоксаминфосфата (Г). Поскольку эти реакции обратимы, аминированная форма трансаминазы передает затем свою аминогруппу на приходящую в результате чего образуется новая аминокислота.
Затем происходит сдвиг двойной связи и гидролитическое отщепление углеродного скелета аминокислоты; при этом ее аминогруппа остается ковалентно связанной с простетической группой в форме пиридоксаминфосфата. Пиридоксаминфосфат образует теперь шиффово основание с приходящим -кетоглутаратом, на который и переносится аминогруппа; перенос совершается, по сути, путем обращения тех реакций, в которых образовался пиридоксаминфосфат.
В медицине определение аланин-трансаминазы и аспартат-трансаминазы в сыворотке крови служит важным методом диагностики и оценки результатов лечения при инфаркте миокарда. Этот же метод используется и для обнаружения токсического действия некоторых химических реактивов (дополнение 19-1).